
Abstrak Grafis
Data voltametri siklik dari elektroda sulfur dan litium telah dikumpulkan dalam campuran elektrolit yang berbeda dengan referensi ferosena yang (hampir) tidak bergantung pelarut. Korelasi yang kuat antara keduanya dapat ditemukan untuk beberapa gelombang sulfur, sementara hanya korelasi yang lemah untuk yang lain. Hal ini menunjukkan ketergantungan yang berbeda pada elektrolit untuk proses yang berbeda dalam baterai litium-sulfur.
Abstrak
Baterai litium–sulfur menjanjikan untuk penyimpanan energi masa depan karena kapasitas spesifiknya yang tinggi. Namun, tantangan seperti stabilitas siklus rendah dan efek shuttle menghambat penggunaan praktisnya. Pemahaman yang lebih baik tentang proses yang mendasarinya sangat penting. Studi ini meneliti korelasi antara potensial litium ( E Li ) dan potensial reaksi sulfur, yang dirujuk terhadap pasangan ferosenium/ferosena sebagai referensi (hampir) independen pelarut. Reaksi sulfur dibagi menjadi dua tahap utama selama pelepasan dan pengisian daya. Sebagian besar reaksi sulfur menunjukkan korelasi linier yang baik dengan E Li (R 2 hingga 0,87), kecuali untuk reduksi awal S 8 menjadi Li 2 S 8 , yang tidak menunjukkan korelasi signifikan. Ini menunjukkan desain elektrolit harus membahas reaksi sulfur individual daripada memperlakukannya secara kolektif. Selain itu, korelasi antara E Li dan mode peregangan S–N–S simetris aktif Raman v s (SNS) dalam anion elektrolit Li[N(SO 2 CF 3 ) 2 ] dianalisis di seluruh campuran elektrolit yang berbeda. Korelasi linier yang baik (R 2 = 0,73) menunjukkan bahwa posisi puncak Raman dan E Li mencerminkan kekuatan interaksi antara Li + dan pelarut elektrolit dan karenanya aktivitas ion Li + . Temuan ini memberikan wawasan berharga untuk mengoptimalkan elektrolit baterai litium-sulfur.
1 Pendahuluan
Perburuan baterai pasca-litium yang akan dapat menggantikan baterai ion-litium (LIB) di masa mendatang masih berlangsung. Kandidat kuat untuk aplikasi yang menuntut kepadatan energi tinggi adalah baterai litium-sulfur (LISB). Meskipun pada voltase yang relatif rendah, ia menawarkan kapasitas katode teoritis yang sangat tinggi sebesar 1672 mAh g −1 yang dipadukan dengan harga yang rendah dan dampak lingkungan yang rendah dari bahan katode utamanya, sulfur. [ 1 – 3 ] Meskipun kapasitas pelepasan katodenya secara signifikan lebih rendah, dengan, misalnya, kapasitas teoritis sebesar 274 mAh g −1 untuk LiCoO 2 , LIB menawarkan kemampuan siklus dan efisiensi yang luar biasa, terkadang lebih tinggi dari 99,9 %. [ 4 – 7 ] Kualitas-kualitas ini masih kurang dalam LISB karena berbagai faktor, seperti pelarutan spesies sulfur dan pengangkutannya ke sisi elektroda negatif, diikuti oleh reaksi samping yang tidak diinginkan. [ 8 , 9 ] Untuk baterai litium–logam, telah ditunjukkan bahwa potensial litium dalam elektrolit yang berbeda merupakan indikator yang baik untuk reversibilitas sistem baterai, dengan potensial yang lebih rendah berkorelasi dengan efisiensi Coulombik (CE) yang lebih rendah. [ 10 ] Sementara jendela potensial tetap sama, potensial Li/Li + berubah dengan elektrolit, dan potensial yang lebih rendah tampaknya menunjukkan kecenderungan yang lebih kuat untuk reaksi samping, termasuk yang dengan elektrolit. Reaksi samping tersebut merupakan salah satu kontributor paling substansial terhadap efisiensi Coulombik yang lebih rendah dan kinerja siklus yang buruk. [ 11 , 12 ] Ini menyiratkan bahwa pilihan elektrolit yang cermat mengenai efek ini dapat menghasilkan kinerja baterai yang lebih baik. Dengan demikian, efek elektrolit pada reaksi baterai dan reaksi samping yang tidak diinginkan untuk LISB telah menjadi fokus penelitian, karena reaksi baterai terutama terjadi pada elektrolit dan bukan pada material massal. [ 13 – 15 ] Dibandingkan dengan kasus LIB, jumlah spesies yang terlibat dalam LISB jauh lebih tinggi karena sulfur mengalami reduksi multi langkah dari S 8 menjadi Li 2 S sebagai bagian dari reaksi baterai. [ 16 , 17 ]
Tujuan dari studi ini adalah untuk menyoroti bagaimana pilihan elektrolit mempengaruhi semua potensial elektrokimia dari spesies yang berbeda yang terlibat dalam reaksi baterai LISB. Telah ditunjukkan bahwa potensial litium ( E Li ), yang sangat bergantung pada interaksi antara ion Li + – dan pelarut elektrolit (yaitu, aktivitasnya), berkorelasi dengan potensial di mana puncak reduksi dan oksidasi yang berbeda dapat diukur dalam sistem Li–S jika diukur versus ferosena sebagai standar internal dan referensi (hampir) independen pelarut. Korelasi ini tidak sama untuk semua reaksi sulfur, yang menunjukkan bahwa efek yang berbeda memengaruhi potensial elektroda Li E Li dan potensial yang terkait dengan reduksi sulfur E S1 , E S2 , E S3 , dan E S4 . Selain itu, posisi mode peregangan SNS aktif Raman vs s (SNS) dalam litium bis(trifluoromethanesulfonyl)imide (LiTFSI) diselidiki. Ini adalah ukuran tidak langsung untuk aktivitas ion Li + dan telah ditunjukkan berkorelasi dengan E Li untuk litium bis(fluorosulfonyl)imide (LiFSI), dan korelasi serupa untuk LiTFSI, yang sebagian besar digunakan dalam LISB, telah ditunjukkan. [ 9 , 10 ] Tujuan dari langkah ini adalah untuk memverifikasi apakah E Li terlalu bergantung pada reaksi samping yang melibatkan pelarut reaktif di permukaan dalam sistem ini. Posisi v s (SNS) tidak bergantung pada efek ini, merasakan aktivitas kation Li + , dan karena itu sangat cocok untuk perbandingan tersebut. Korelasi antara keduanya menunjukkan bahwa E Li memang dapat digunakan, yang memungkinkan ketergantungan hanya pada pengukuran elektrokimia untuk korelasi yang diselidiki di sini.
2 Hasil dan Pembahasan
2.1 Potensi Litium dan Posisi Puncak v s (S–N–S)
Sebanyak 23 larutan elektrolit disiapkan untuk digunakan dalam penelitian ini. Larutan tersebut terdiri dari pelarut dan LiTFSI sebagai garam penghantar. Daftar lengkapnya dapat ditemukan di Tabel S1, Informasi Pendukung. Daftar ini terdiri dari pelarut dan campuran pelarut yang digunakan dalam LISB sebelumnya, ditambah dimetil karbonat (DMC), yang tidak dapat digunakan dalam LISB karena reaksinya dengan litium polisulfida, tetapi merupakan pelarut umum dalam jenis baterai lainnya, itulah sebabnya penggunaannya terbatas pada bagian pertama penelitian ini. Konsentrasi standar yang digunakan adalah 1 m LiTFSI, tetapi untuk beberapa pelarut, pengukuran tambahan pada 0,2 m LiTFSI ditambahkan untuk mengumpulkan lebih banyak titik data.
2.1.1 Voltammetri Siklik
Metodologi umum untuk menentukan potensial adalah voltametri siklik (CV). [ 18 ] Kebutuhan untuk mengukur potensial elektroda yang (hampir) tidak bergantung pada pelarut, tergantung pada elektrolitnya, memerlukan referensi yang tidak bergantung pada elektrolitnya. Standar internal yang sesuai dan umum digunakan adalah Ferrosena (Fc), karena ‘Asumsi Ferrosena’ yang direkomendasikan IUPAC menyatakan bahwa pasangan Fc + /Fc menampilkan potensial yang (hampir) tidak bergantung pada pelarut pada berbagai pelarut. [ 19 , 20 ] Fc juga digunakan di sini, jika berlaku. Penggunaan Fc tidak mungkin dilakukan untuk beberapa pelarut yang kurang polar, dan dekametilferrosena (Me 10 Fc) digunakan sebagai gantinya. Me 10 Fc juga dapat digunakan sebagai standar internal untuk alasan yang sama seperti Fc. [ 21 ] Untuk menyatukan nilai-nilai pengukuran ini, pengukuran potensi litium Li/Li + dilakukan dalam dimetoksietana (DME) dengan Fc dan Me 10 Fc, dan nilai-nilai Me 10 Fc dalam semua pengukuran lainnya dikoreksi oleh perbedaan potensial antara Fc dan Me 10 Fc yang diukur dalam DME. ‘Asumsi Ferosena’ bahwa potensi Fc tidak bergantung pada efek pelarut tidak sepenuhnya akurat, dan masih ada fluktuasi kecil dalam potensi Fc, meskipun secara signifikan lebih kecil daripada Li. Karena alasan ini, diasumsikan kesalahan sistematis dalam pengukuran ini sebesar 40 mV. Nilai ini sejalan dengan pengukuran sendiri dari energi transfer Gibbs dari sistem Fc + /Fc antara pelarut yang berbeda menggunakan metodologi jembatan garam cairan ionik ‘ideal’. [ 22 – 25 ] Kesalahan yang sama ini diterapkan pada nilai-nilai yang diukur dalam Me 10 Fc. Semua pengukuran dilakukan dengan elektroda kerja platina (WE) dan strip litium sebagai elektroda referensi (RE) dan elektroda bantu (AE). Hasil pengukuran dikompilasi dalam Tabel S2, Informasi Pendukung. Sementara potensi sebenarnya dari E Li seharusnya tidak bergantung pada antarmuka elektrolit padat, diputuskan untuk memilih konfirmasi asumsi ini menggunakan pengukuran Raman untuk menyelidiki apakah efek lain mungkin memengaruhi pengukuran kami terlalu kuat. [ 10 ]
2.1.2 Pengukuran Raman
Mereka dilakukan untuk sistem elektrolit yang sama, dan posisi puncak mode peregangan SNS simetris anion TFSI antara 740 dan 750 cm −1 ditandai pada Gambar 1 a–c . Data individual dapat ditemukan pada Tabel S3, Informasi Pendukung. Data E Li kemudian diplot versus posisi puncak Raman dari v s (S–N–S) pada Gambar 1d , dan regresi linear dilakukan, yang menunjukkan hubungan yang kuat antara pengukuran ini. Efek ini disebabkan oleh kemampuan koordinasi pelarut apa pun yang memengaruhi potensial/aktivitas Li + dalam larutan. Selain itu, koordinasi yang kuat dari pelarut dan Li + menghasilkan ion yang dipisahkan oleh pelarut dengan interaksi yang lebih lemah antara TFSI − dan Li + , yang kemudian memengaruhi posisi puncak v s (S–N–S) dalam pengukuran Raman dan menggesernya ke bilangan gelombang yang lebih rendah seperti yang ditunjukkan dalam Skema 1 . [ 10 ] Sebaliknya, koordinasi mono- atau bidentat Li + memolarisasi unit S–N–S secara positif dan mengarah pada pergeseran biru/frekuensi peregangan S–N–S yang lebih besar. Ini menyiratkan bahwa posisi pita v s (S–N–S) berkorelasi kuat dengan potensial kimia dan aktivitas ion Li + dalam larutan, dan, karena tidak ada litium metalik yang hadir selama pengukuran Raman, hal itu tidak terpengaruh oleh kelebihan potensial elektroda atau efek serupa. Korelasi yang baik antara v s (S–N–S) dan E Li menyiratkan bahwa potensial litium E Li dapat dilihat sebagai indikator kekuatan interaksi Li + dan molekul pelarut yang hadir dalam elektrolit. Nilai E Li yang rendah menandakan interaksi yang lebih kuat dengan elektrolit, dan nilai E Li yang lebih tinggi menandakan interaksi yang lebih lemah dengan elektrolit. Dibandingkan dengan distribusi posisi puncak v s (S–N–S) yang diamati untuk elektrolit yang mengandung FSI− sebagai anion, distribusi nilai yang diukur di sini lebih kecil. Distribusi untuk FSI − mencakup rentang sekitar 60 cm −1 , sedangkan data yang diukur di sini hanya tersebar pada 10 cm −1 . [ 10 ] Pengamatan ini sejalan dengan perbedaan yang cukup besar dalam perubahan posisi puncak saat mengganti pelarut antara TFSI − dan FSI− dilaporkan di tempat lain. [ 26 ]
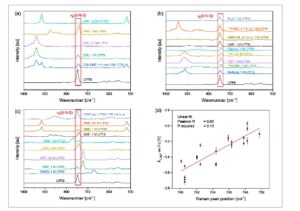
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
v s (S–N–S) Data Raman dari berbagai elektrolit. a) Pengukuran dalam DOL dan DME serta campurannya. b) Pengukuran dalam pelarut eter lainnya. c) Pengukuran dalam berbagai jenis pelarut. d) Korelasi posisi puncak Raman v s (S–N–S) dan potensi litium versus ferosena. Singkatan yang digunakan untuk pelarut tercantum dalam Tabel S1, Informasi Pendukung.
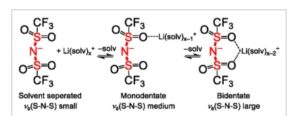
Skema 1
Buka di penampil gambar
Kekuatan Gambar
Pergeseran posisi puncak v s (S–N–S) bergantung pada koordinasi pelarut dan LiTFSI ke Li + . Perhatikan bahwa situasi di sebelah kiri menandakan aktivitas ion Li + – yang lebih tinggi , daripada di tengah, dan terakhir di sebelah kanan. Oleh karena itu, posisi puncak Raman v s (S–N–S) juga merupakan ukuran untuk besarnya aktivitas ion Li + – dan karenanya potensi kimianya.
2.2 Pengukuran Potensi Sulfur
2.2.1 Pengaturan Pengukuran
Pengukuran CV sulfur terhadap litium dilakukan menggunakan elektroda kerja sulfur (Nanopowder Enterprises Incorporated (NEI)), elektroda bantu litium, dan elektroda referensi litium pada laju pindai rendah 0,1 mV s −1 , yang meminimalkan efek kelebihan potensial, dalam pengaturan sel khusus. Bagian-bagian individual dari pengaturan tersebut ditunjukkan pada Gambar 2 . Bagian luar sel terdiri dari sekrup PVDF ( Gambar 3 a ) dan badan PVDF (Gambar 2b ) yang digunakan untuk menyatukan semua komponen sel. Kolektor arus tembaga (Gambar 2c ) dihubungi dengan WE sulfur dan AE litium dan disegel terhadap ruang elektrolit Teflon (Gambar 2f ) menggunakan bahan penyegel biru (Gambar 2e , Ice Cube Sealing 35 FC-PO 100 dari Freudenberg). Lithium RE dibuat dengan membuat permukaan lithium baru dan menekan lithium ke stempel tembaga yang dilapisi oleh polieter eter keton (PEEK) yang ditunjukkan pada Gambar 2d . Sebuah spacer (Gambar 2g ) digunakan untuk memastikan bahwa sekrup dapat memberikan tekanan yang cukup pada sel untuk menyegelnya dengan cara yang tidak memungkinkan kebocoran elektrolit. Gambar 3a menunjukkan tampilan atas sel yang telah dirakit dengan dan tanpa lithium RE. Gambar 3b menunjukkan skema yang merinci urutan tumpukan sel. Pengukuran potensial sulfur dalam elektrolit yang berbeda kurang mudah. Pertama, sulfur bereaksi dalam proses multi langkah dari S8 ke Li2S . [ 8 ] Selain itu, langkah-langkah reaksi tidak selalu sama untuk elektrolit yang berbeda. [ 17 , 27 ] Hal ini dapat menyebabkan puncak-puncak saling tumpang tindih, puncak-puncak menghilang, atau puncak-puncak baru muncul setelah mengganti elektrolit. [ 28 ] Hal ini menyebabkan tidak semua pengukuran CV menunjukkan jumlah puncak yang sama. Dengan demikian, untuk mengevaluasi data yang dikumpulkan secara efektif dan membandingkan efek perubahan elektrolit, diputuskan untuk mengurutkan semua data CV sulfur yang diukur menjadi empat titik diskrit: E S1 , E S2 , E S3 , dan E S4 . Ini mengikuti pola yang umum dilaporkan dari dua dataran tinggi pelepasan yang berbeda yang dicerminkan oleh dua dataran tinggi pengisian, seperti yang ditunjukkan pada Gambar 4a . Tidak ada reaksi polisulfida (PS) spesifik yang dikaitkan dengan setiap puncak, karena ini sangat bergantung pada elektrolit. Sebaliknya, reaksi umum S 8 terhadap PS S x2− , tergantung pada elektrolitnya, kemungkinan besar campuran S82− , S62− , dan S42− dalam rasio yang berbeda, dan Sx2− ke sulfida berantai pendek Sy2− ( terutama S22− ) diasumsikan. Pola ini ditunjukkan pada Gambar 4b . Jika lebih banyak puncak terlihat , puncak utama diidentifikasi dan dikelompokkan ke dalam empat set yang sama, seperti yang ditunjukkan pada Gambar 4c . Akhirnya , jika lebih sedikit puncak terlihat, diasumsikan bahwa puncak-puncak tersebut tumpang tindih, dan nilai yang sama diberikan pada dua puncak, seperti yang ditunjukkan pada Gambar 4d . Perbedaan posisi puncak tergantung pada nomor siklus dapat diamati, itulah sebabnya data untuk siklus pertama dan ketiga dikumpulkan. Data yang dikumpulkan kemudian digabungkan dengan data untuk ELi dari elektrolit yang sesuai untuk menghitung potensi sulfur terhadap Fc menurut Persamaan ( 1 ).

Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Bagian-bagian individual dari sel CV yang digunakan dalam penelitian ini. a) Sekrup PVDF, digunakan untuk memfiksasi komponen-komponen. b) Badan PVDF. c) Dua kolektor arus tembaga untuk WE dan AE. d) Kolektor arus tembaga terbungkus dalam PEEK untuk AE. e) Bahan penyegel Es Batu Freudenberg Biru. f,g) Sisipan Teflon digunakan sebagai ruang elektrolit.
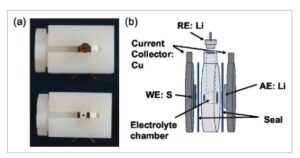
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Sel CV yang telah dirakit. a) Tampilan atas sel yang telah dirakit dengan dan tanpa RE. b) Skema yang merinci urutan tumpukan untuk sel.
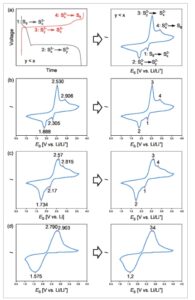
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
Pengukuran CV S versus Li/Li + dan penetapan nilai pada empat puncak yang sesuai dengan dua dataran tinggi pengisian dan dua dataran tinggi pengosongan yang umum diamati pada baterai litium-sulfur. Semua pengukuran dilakukan dengan litium sebagai elektroda bantu (AE) dan elektroda lawan (CE) dan sulfur sebagai elektroda kerja (WE) dengan laju pemindaian 0,1 mv s −1 . Informasi terperinci untuk setiap pengukuran individual dapat ditemukan dalam informasi pendukung di bawah pengukuran CV. a) Penetapan reaksi sel pada puncak CV yang diamati. b) CV dengan empat titik data. c) CV dengan lebih dari empat titik data. d) CV dengan kurang dari empat titik data.
Kesalahan dihitung menggunakan perambatan kesalahan Gaussian. Data untuk siklus CV pertama dirangkum dalam Tabel S4, Informasi Pendukung (potensial vs. Li + /Li), dan Tabel S6, Informasi Pendukung (potensial vs. Fc + /Fc), dan data untuk siklus ketiga dirangkum dalam Tabel S5, Informasi Pendukung (potensial vs. Li + /Li) dan Tabel S7, Informasi Pendukung (potensial vs. Fc + /Fc).
Data untuk kedua siklus kemudian diplot terhadap data untuk E Li untuk menyelidiki apakah potensial sulfur dipengaruhi oleh pelarut dengan cara yang sama seperti E Li . Plot untuk siklus pertama (c1) dapat dilihat pada Gambar 5 dan plot untuk siklus ketiga (c3) pada Gambar S1, Informasi Pendukung. Untuk semua plot, regresi linier telah dilakukan. Seperti yang dibahas, nilai E Li yang lebih rendah menunjukkan interaksi yang lebih tinggi dari Li + dan pelarut elektrolit dan, karenanya, aktivitas ion Li + yang lebih rendah . Ini, pada gilirannya, menyiratkan bahwa korelasi potensial sulfur E S1 , E S2 , E S3 , dan E S4 dapat dilihat sebagai indikator pengaruh interaksi Li + , yaitu, aktivitasnya, dan pelarut elektrolit pada reaksi redoks sulfur umum yang telah ditetapkan pada puncak pengukuran CV. Secara umum, puncak gelombang reduksi CV sulfur menunjukkan korelasi yang lebih lemah daripada puncak gelombang oksidasi. Yang paling menonjol, puncak sulfur pertama dari siklus pertama, E S1 , c1 , tidak menunjukkan korelasi linier. Oleh karena itu, reaksi ini didominasi oleh efek lain selain E Li , kemungkinan besar pelarutan PS. Hal ini diketahui memiliki efek signifikan pada kinerja LISB. Karena semua langkah lainnya dimulai dengan PS bermuatan negatif dalam larutan, ini adalah satu-satunya langkah di mana sulfur (= molekul S 8) berubah dari bentuk padat menjadi bentuk terlarut. Menariknya, korelasi tertinggi dapat diamati untuk reaksi kebalikan keempat, di mana produknya adalah sulfur padat. Ini menunjukkan bahwa hanya pelarutan dan aktivasi sulfur yang sangat bergantung pada pelarut, sedangkan oksidasi dan presipitasi kurang bergantung padanya. Hal ini mengakibatkan potensi reaksi keempat didominasi oleh efek yang sama yang menentukan potensi litium. Korelasi yang lebih kuat selama siklus pertama dibandingkan dengan siklus selanjutnya diharapkan, karena siklus pertama menunjukkan keadaan di mana spesies sulfur belum larut dalam elektrolit, sehingga meminimalkan pengaruhnya terhadap potensi yang diukur. Menariknya, kekuatan korelasi sebagian besar tetap tidak berubah antara siklus pertama dan ketiga, meskipun posisi absolut dari potensi memang bergeser. Ini ditafsirkan sebagai indikasi bahwa, setidaknya dalam pelarut yang diselidiki di sini, reaksi samping, seperti reaksi sulfur dengan elektroda Li, memang ada, tetapi memengaruhi sistem yang berbeda dengan cara yang sama atau memiliki dampak yang jauh lebih kecil daripada perbedaan antara sistem elektrolit. Meskipun tidak ada konfirmasi melalui pengukuran Raman yang dapat dilakukan untuk potensi sulfur, korelasi yang diamati dengan E Li menunjukkan bahwa pengukuran ini menghasilkan nilai yang konsisten dan andal, bahkan dengan adanya reaksi samping seperti efek shuttle, yang tidak dapat ditangkap dalam pengukuran yang dilakukan di sini dan merupakan kelemahan metode ini. Data yang disajikan di sini menunjukkan bahwa berbagai proses yang terjadi di LISB harus dipertimbangkan secara individual saat merancang elektrolit. Secara optimal, elektrolit dapat dipilih yang menawarkan kondisi yang menguntungkan untuk reaksi PS yang terjadi dalam larutan, sementara juga mendukung reaksi pelarutan yang dimulai dengan sulfur padat. Saat mempertimbangkan reaksi samping yang tidak diinginkan dalam baterai, ini juga membuka kemungkinan untuk menyetel elektrolit agar mendukung reaksi tertentu dalam baterai sulfur sambil menekan yang lain. Meskipun data yang disajikan di sini tidak berisi informasi tentang kualitas sel baterai yang dibangun dengan masing-masing elektrolit, ini memberikan wawasan tentang prinsip kerja LISB.
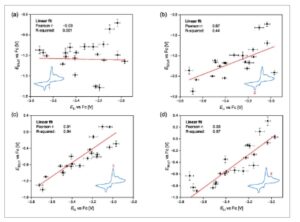
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Korelasi linear potensial litium E Li dan potensial sulfur dari siklus CV pertama untuk empat puncak berbeda yang diamati. a) Puncak sulfur pertama dari siklus pertama E S1, c1 tidak menunjukkan korelasi dengan E Li . b) Puncak sulfur kedua dari siklus pertama E S2, c1 , menunjukkan korelasi sedang dengan E Li . Puncak sulfur ketiga c) dan keempat d) dari siklus pertama E S3, c1 /E S4, c1 berkorelasi baik dengan E Li .
3 Kesimpulan
Dalam studi ini, ditunjukkan bahwa posisi mode peregangan S–N–S aktif Raman vs (S–N–S) dalam larutan elektrolit dengan garam konduksi LiTFSI berkorelasi dengan potensi litium E Li dalam campuran elektrolit yang berbeda dan mengikuti laporan sebelumnya untuk garam elektrolit LiFSI terkait. Ini menyiratkan bahwa E Li , serta posisi mode vs ( S –N–S), adalah indikator yang baik untuk interaksi antara Li + dan elektrolit, yaitu, aktivitas ion Li + – . Korelasi antara puncak yang berbeda yang diamati dalam CV sulfur dan E Li mengandung informasi tentang apakah interaksi antara elektrolit dan Li + ini memainkan peran penting dalam kimia redoks sulfur. Di sini, ditemukan bahwa posisi puncak CV sulfur pertama yang diamati, reaksi molekul S 8 terhadap PS rantai panjang, tidak menunjukkan korelasi dengan E Li . Puncak yang ditetapkan untuk reaksi kedua, reduksi PS rantai panjang, menunjukkan korelasi sedang. Puncak untuk reaksi ketiga dan keempat, yang merupakan reaksi oksidasi yang terjadi selama pengisian baterai, menunjukkan korelasi yang baik dengan E Li . Ini menyiratkan bahwa pelarutan sulfur selama pelepasan LISB didominasi oleh efek lain, kemungkinan besar kelarutan sulfur dan polisulfida. Selain itu, korelasi antara puncak sulfur ketiga dan keempat dengan E Li juga menunjukkan bahwa keduanya bergantung pada karakteristik elektrolit yang sama. Ini membuka pintu untuk pemahaman yang lebih baik tentang LISB. Saat merancang elektrolit dengan mempertimbangkan kinerja baterai, informasi yang disajikan di sini memberikan kemampuan untuk membuat keputusan yang tepat tentang sifat pelarut yang memengaruhi baterai. Ini juga membuka pintu untuk studi lebih lanjut yang menyelidiki hubungan antara kinerja baterai dan potensi litium dan reaksi sulfur dalam pelarut yang berbeda. Sementara investigasi semacam itu berada di luar cakupan pekerjaan ini, saat ini, studi lanjutan yang mencakup pengukuran kinerja dan pengukuran arus shuttle di samping pengukuran potensial yang dibahas di sini sedang dilakukan. Tujuannya adalah untuk mengevaluasi bagaimana potensi individu dari reaksi sulfur berhubungan dengan kinerja baterai secara keseluruhan. Ini akan diikuti oleh penyaringan skala besar terhadap sekitar 3000 pelarut menggunakan data potensial kimia berbagai spesies dalam campuran elektrolit yang dihitung dengan COSMO-RS dan sifat pelarut, yang ditujukan untuk mengidentifikasi dan menguji campuran elektrolit baru yang potensial untuk digunakan dalam baterai litium–sulfur.

