
Abstrak Grafis
Kalium iodida berfungsi sebagai reagen transfer elektron, dimetil sulfoksida sebagai pelarut dan sumber sulfur, batang karbon sebagai anoda, dan lembaran magnesium sebagai katoda. Tiometilasi ringan dari alkuna terminal berhasil dicapai dalam kondisi elektrokatalitik. Produk terdeuterasi juga dapat diperoleh dengan menggunakan dimetil sulfoksida-d 6 sambil mempertahankan hasil.
Abstrak
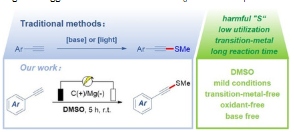
Sebuah protokol untuk metiltiolasi alkuna terminal telah dikembangkan, memanfaatkan strategi elektrokimia dengan dimetil sulfoksida sebagai pelarut dan reagen metiltiolasi. Reaksi elektrokimia organik ini, yang menggunakan reagen yang tersedia secara komersial, berlangsung secara efisien pada suhu ruangan dalam kondisi bebas logam transisi, bebas oksidan/reduktor eksternal, dan bebas basa. Metode ini menghasilkan beragam alkuna sulfida dengan hasil yang memuaskan dan menunjukkan kompatibilitas gugus fungsi yang luas.
1 Pendahuluan
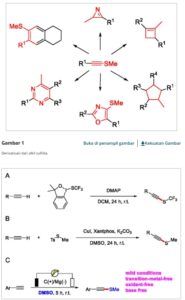
Sulfida alkuna merupakan blok pembangun yang sangat serbaguna dalam sintesis organik, dan konversi cepatnya menjadi cincin beranggota tiga hingga enam dapat dicapai [ 1 – 6 ] ( Gambar 1 ). Dibandingkan dengan proses pembentukan ikatan S C sp 3 dan S C sp 2 yang sudah mapan , [ 7 – 13 ] metode untuk membangun ikatan S C sp masih jarang. [ 14 ] Saat ini, sebagian besar rute sintesis melibatkan penggunaan iodin bervalensi tinggi sebagai prekursor untuk membentuk sulfida alkuna dalam kondisi basa kuat ( Skema 1A ) [ 15 ] atau mereaksikan merkaptan atau tiofenol dengan haloalkuna dengan adanya katalis logam transisi untuk membentuk tio-alkuna ( Skema 1B ). [ 16 ] Namun, metode ini biasanya memerlukan pra-aktivasi sumber sulfur atau alkuna, yang mengarah pada produksi produk sampingan yang signifikan. Akibatnya, toleransi gugus fungsi terbatas yang terkait dengan metode ini tidaklah mengejutkan, karena metode ini sering kali berjalan dalam kondisi yang keras, melibatkan zat antara yang sangat reaktif, atau bergantung pada sistem katalitik yang sensitif.
Skema 1
Buka di penampil gambar
Kekuatan Gambar
Latar belakang penelitian. A) Ikatan S C sp dari sumber sulfur yang telah diaktifkan sebelumnya. B) Ikatan S C sp secara langsung membentuk tiol. C) Pekerjaan ini.
Oleh karena itu, pengembangan metode yang mudah, efisien, dan ringan untuk sintesis alkuna sulfida tanpa perlu praaktivasi menjadi sangat penting. Dengan semakin fokusnya pada kimia hijau dan kemajuan dalam teknologi elektrokimia, sintesis hijau elektrokimia telah muncul sebagai pendekatan yang ramah lingkungan. Bidang ini telah menunjukkan contoh-contoh elegan fungsionalisasi ikatan C H melalui reaksi katalis logam elektrokimia, menggunakan listrik sebagai reagen yang bersih dan terbarukan. Namun, laporan tentang pembentukan ikatan S C sp elektrokatalitik masih terbatas.
Penggunaan dimetil sulfoksida (DMSO) sebagai reagen metiltiolasi dalam fungsionalisasi heterosiklus telah menarik perhatian signifikan dalam beberapa tahun terakhir. Ahmed dan rekan melaporkan metode yang dipromosikan I 2 –DMSO untuk sintesis selektif α-ketometiltioester dari asetilena. [ 17 ] Demikian pula, kombinasi kalium iodida (KI) dan DMSO digunakan untuk mencapai pembentukan ikatan S C sp 2 . [ 18 ] Berdasarkan karya-karya ini, kami berhipotesis bahwa konstruksi tio-alkuna dapat dicapai melalui oksidasi elektrokimia menggunakan garam iodida bervalensi rendah. Dengan mengingat hal ini, kami bertujuan untuk mengeksplorasi kelayakan metode yang lebih efisien dan praktis secara eksperimental untuk mengakses tio-alkuna (Skema 1C ).
2 Hasil dan Pembahasan
Penelitian ini dimulai dengan 4-klorofenilasetilena ( 1a ) sebagai substrat model, menggunakan KI yang tersedia secara komersial sebagai aditif, n Bu 4 NPF 6 sebagai elektrolit, batang grafit sebagai anoda, pelat magnesium sebagai katoda, dan DMSO sebagai pelarut. Setelah bereaksi pada suhu kamar selama 5 jam di bawah arus 15 mA dalam sel yang tidak terbagi, produk yang diinginkan 2a diperoleh dengan hasil 71% ( Tabel 1 , entri 1). Campuran pelarut MeCN/DMSO (v/v = 1:1) menghasilkan hasil yang buruk (entri 2). Mengganti KI dengan aditif lain, seperti NIS, NaI, TBAI, atau NaBr, menyebabkan konversi rendah, menghasilkan produk 2a dengan hasil mulai dari 8 hingga 27% (entri 2–6). Mengurangi jumlah KI menjadi 1,0 ekuivalen atau 2,0 ekuivalen. gagal mempertahankan hasil (entri 7–8). Menggunakan n Bu4 NBF4 atau n Bu4 NClO4 sebagai elektrolit menyebabkan hasil yang lebih rendah (entri 9–10). Peningkatan suhu reaksi tidak meningkatkan hasil (entri 11–12). Selain itu, perubahan bahan elektroda tidak meningkatkan hasil 2a ( entri 13–15 ). Kami juga menyelidiki efek atmosfer gas dan menemukan bahwa hasil menurun tajam dalam kondisi udara (entri 16). Percobaan kontrol mengonfirmasi bahwa arus listrik dan KI penting, karena reaksi tanpa komponen ini memberikan hasil yang buruk (entri 17–18).
Tabel 1. Optimasi kondisi reaksi.
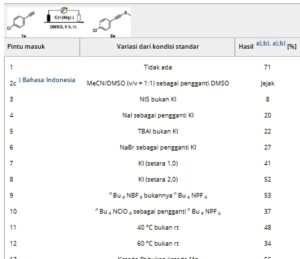
a) Kondisi standar: 1a (0,2 mmol), C(+)/Mg(−), KI (0,6 mmol, 3,0 ekuivalen), n Bu 4 NPF 6 (0,3 mmol, 1,5 ekuivalen), 15 mA, DMSO (5 mL), sel tak terbagi, rt, 5 jam, N 2 .
b) Hasil terisolasi.
c) MeCN (2,5 mL)/DMSO (2,5 mL).
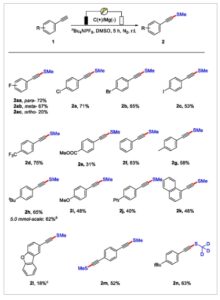
Dengan kondisi reaksi yang dioptimalkan, cakupan substrat dari reaksi elektrokimia ini dieksplorasi berkenaan dengan berbagai alkuna aromatik ( Skema 2 ). Pertama, fenilena yang disubstitusi-halogen dievaluasi, dan reaksinya menoleransi berbagai gugus para -halogen, menghasilkan produk yang sesuai 2a–2c dan 2aa dalam hasil sedang hingga baik (53–72%). Namun, ketika substituen halogen berada dalam posisi meta ( 2ab ), hasil menurun hingga 67%, sementara dalam posisi orto ( 2ac ), hasil menurun secara signifikan hingga 20%. Dalam beberapa gugus penarik elektron lain yang diposisikan pada lokasi para fenilasetilena, termasuk CF 3 ( 2d ) dan CO 2 Me ( 2e ), masing-masing diperoleh hasil isolasi sebesar 75% dan 31%.
Skema 2
Buka di penampil gambar
Kekuatan Gambar
Ruang lingkup substrat a . a) Kondisi standar. b) 2 jam (5,0 mmol), KI (15,0 mol), n Bu 4 NPF 6 (15,0 mol), DMSO (30,0 mL), dan 50 mA, 40 jam. c) 77% pemulihan bahan baku.
Ketika fenilasetilena digunakan sebagai substrat, produk target 2f diperoleh dengan hasil 63%. Kelompok donor elektron yang menggantikan fenilasetilena, termasuk alkil ( 2g dan 2h ), metoksil ( 2i ), dan fenil ( 2j ), menghasilkan produk target dengan hasil sedang hingga baik (40–65%). Lebih jauh, 1-naftilina bereaksi dengan lancar dalam kondisi standar; produk metiltiolasi yang sesuai 2k diperoleh dengan hasil 46%. Ketika substrat mengandung heterosiklus, produk target 2l juga dapat diperoleh dengan hasil 18% dengan pemulihan bahan baku sebesar 77%. Lebih jauh, 1,4-dietilbenzena adalah substrat yang efisien; produk dimetiltiolasi 2m dapat diperoleh dengan hasil 52%. Perlu disebutkan bahwa dengan menggunakan DMSO – d6 sebagai pelarut, produk terdeuterasi 2n dapat diisolasi dengan hasil 63%. Hal ini menunjukkan potensi metode ini untuk pelabelan deuterium dari alkuna. Untuk menunjukkan penerapan praktis metode ini, kami melakukan reaksi peningkatan skala. Dengan menggunakan 5,0 mmol 1 jam dalam 30 mL DMSO di bawah arus 50 mA selama 40 jam, diperoleh 0,64 g (hasil 63%) produk metiltiolasi 2 jam .
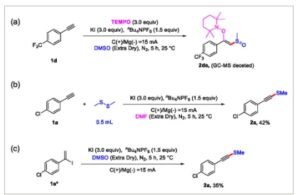
Untuk menyelidiki mekanisme reaksi ini, kami kemudian melakukan beberapa studi mekanistik. Seperti yang ditunjukkan dalam Skema 3 , kami menambahkan TEMPO sebagai aditif dalam kondisi standar (Skema 3 (a)); produk 2da yang ditangkap TEMPO dideteksi oleh kromatografi gas-spektrometri massa. Ketika kami menggunakan dimetil disulfida sebagai prekursor radikal metiltiol dan DMF sebagai pelarut, produk 2a diperoleh dengan hasil 42% dengan sukses (Skema 3 (b)). Hasil ini menunjukkan bahwa radikal sulfur dan radikal alkenil terlibat dalam transformasi. Selanjutnya, 1a* digunakan dalam kondisi standar (Skema 3 (c)); produk yang sesuai 2a juga diperoleh dengan hasil 35%, yang menunjukkan proses eliminasi mungkin terjadi.
Untuk mendapatkan wawasan yang lebih dalam tentang mekanisme reaksi, kami melakukan eksperimen voltametri siklik (CV) ( Gambar 2 ). Dengan menggunakan DMSO sebagai pelarut dalam eksperimen blanko, tidak ada puncak oksidasi yang diamati. Setelah menambahkan KI ke DMSO, dua puncak oksidasi yang jelas diamati pada 1,18 V vs. Ag/AgCl dan 1,31 V vs. Ag/AgCl, yang secara kuat menunjukkan bahwa DMSO dapat dioksidasi dalam larutan KI dengan kondisi elektrokimia. KI dan DMSO juga dapat dioksidasi di anoda dan bertindak sebagai elektrolit secara bersamaan. Selain itu, tidak ada puncak oksidasi yang jelas dari 2a yang diamati dalam kisaran 0–2,0 V, yang menunjukkan bahwa langkah awal mungkin adalah oksidasi KI dan DMSO. Kami juga menjelaskan analisis DVP untuk mengkarakterisasi langkah-langkah oksidasi secara rinci, yang menunjukkan bahwa KI teroksidasi terlebih dahulu, yang mengungkapkan bahwa KI bertindak sebagai mediator dalam oksidasi DMSO.
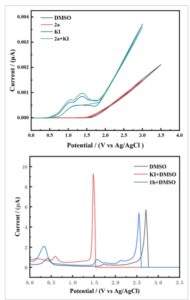
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
Percobaan CV dan voltametri pulsa diferensial.
Berdasarkan fakta-fakta percobaan di atas dan laporan-laporan terkait sebelumnya, [ 19 , 20 ] mekanisme yang masuk akal diajukan untuk metiltiolasi regioselektif elektrokimia alkuna aromatik terminal ini ( Gambar 3 ). Awalnya, dimetil sulfoksida menjalani oksidasi di anoda untuk menghasilkan intermediet kation radikal I , yang kemudian diserang oleh DMSO lain untuk menghasilkan intermediet kation II atau III dan radikal (metilsulfinil)metil IV . Dekomposisi II atau III melepaskan CH 3 SH, sementara itu menghasilkan CH 2 O dan H + . Pada saat yang sama, ion iodin teroksidasi, dan radikal iodin dihasilkan pada anoda magnesium. Proses transfer atom hidrogen dari CH 3 SH dengan radikal iodin menghasilkan radikal metiltio V, yang ditangkap oleh alkuna aromatik terminal untuk membentuk intermediet radikal VI . Radikal VI teroksidasi di anoda, menghasilkan kation VII yang sesuai ; sementara itu, produk bifungsional VIII dapat dibentuk dari intermediet VI dan VII . Akhirnya, deprotonasi VII atau eliminasi VIII menghasilkan produk yang diinginkan. Bersamaan dengan itu, hidrogen dilepaskan sebagai produk sampingan di katode.
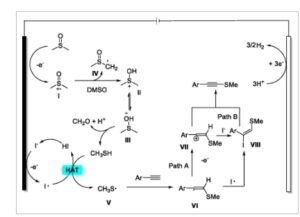
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Kemungkinan mekanisme.
3 Kesimpulan
Singkatnya, kami telah mengembangkan metode metiltiolasi elektrokimia untuk alkuna aril terminal, dengan memanfaatkan DMSO sebagai pelarut dan reagen metiltiolasi. Dengan menggunakan reagen yang tersedia secara umum, transformasi ini berlangsung dalam kondisi bebas logam transisi, bebas oksidan eksternal, dan bebas basa. Selain itu, protokol ramah lingkungan ini memungkinkan sintesis berbagai macam tio-alkuna yang berharga dan menunjukkan toleransi yang baik terhadap berbagai gugus fungsi.

