
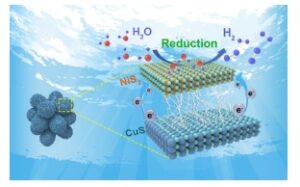
Abstrak Grafis
Di sini, heterojunction S-scheme berhasil dibangun dengan memuat lembaran nano NiS 2 dan CuS yang berasal dari MOF ke CuS berongga. Produksi hidrogen fotokatalitik dari komposit H-CuS/NiS 2 @CuS dapat mencapai 17,66 mmol g −1 h −1 . Kinerja evolusi hidrogen fotokatalitik yang sangat baik dapat dikaitkan dengan medan listrik antarmuka heterojunction S-scheme, yang secara efektif mendorong pemisahan elektron dan lubang yang dihasilkan foto, sehingga mendorong reaksi evolusi hidrogen.
Abstrak
Rekayasa heterojunction dianggap sebagai salah satu cara paling mujarab untuk meningkatkan kinerja evolusi hidrogen dari fotokatalis. Dalam penelitian ini, bimetal MOF-74 ditumbuhkan pada Cu berongga 7 S 4 , dan setelah vulkanisasi, H-CuS/NiS 2 @CuS diperoleh untuk membentuk heterostruktur. Hasil eksperimen menunjukkan bahwa H-CuS/NiS 2 @CuS yang disintesis memiliki laju evolusi hidrogen fotokatalitik yang luar biasa sebesar 17,66 mmol g −1 h −1 , dan kinerja evolusi hidrogen fotokatalitiknya jauh lebih tinggi daripada sulfida logam transisi tunggal. Dalam heterojunction skema-S, medan listrik antarmuka menyebabkan akumulasi fotoelektron yang signifikan pada pita konduksi NiS 2 . Dengan demikian, ia dapat mempertahankan sifat reduksi yang tinggi dalam reaksi evolusi hidrogen dan secara signifikan meningkatkan efisiensi pemisahan fotoelektron dan lubang. Penelitian ini menawarkan skema yang layak untuk sintesis fotokatalis heterojunction yang sangat efisien.
1 Pendahuluan
Kekurangan energi yang disebabkan oleh penggunaan bahan bakar fosil yang berlebihan menjadi tantangan yang signifikan bagi pembangunan ekonomi di seluruh dunia. Evolusi sumber-sumber energi ternyata menjadi tugas yang mendesak. [ 1 – 4 ] Energi hidrogen dianggap sebagai sumber energi alternatif yang sangat baik karena kepadatan energinya yang tinggi dan karakteristik pembakaran yang tidak menimbulkan polusi. [ 5 – 7 ] Mengikuti karya perintis Fujishima dan Honda pada reaksi fotolisis air pada tahun 1972, dekomposisi air fotokatalitik untuk menghasilkan hidrogen diakui sebagai teknologi yang bersih dan efisien untuk mengubah energi matahari menjadi hidrogen. Namun, tingkat pemanfaatan energi matahari relatif rendah di seluruh bidang studi fotokatalis yang ada. [ 8 – 11 ] Oleh karena itu, penting untuk merancang dan membuat fotokatalis dengan efisiensi tinggi.
Sulfida logam (MS), sebagai bahan semikonduktor, memiliki karakteristik fotosensitivitas yang baik, konduktivitas tinggi, dan stabilitas fotoelektrokimia yang sangat baik, sehingga menjadi fotokatalis yang menjanjikan dalam reaksi evolusi hidrogen (HER). [ 12 ] Namun, aktivitas fotokatalitik MS berstruktur padat sering kali terbatas karena kurangnya penyerapan foton insiden rendah, rekombinasi pembawa yang tinggi, situs aktif katalitik yang tidak mencukupi, dan transfer muatan yang lambat. Pengembangan MS berstruktur berongga mengatasi keterbatasan ini. Dibandingkan dengan katalis berstruktur nano padat, semikonduktor dengan karakteristik berstruktur nano berongga yang unik lebih cocok untuk fotokatalisis. [ 13 ] Pada tahun 2024, Ding dan Yang et al. [ 14 ] menyiapkan serangkaian bahan sulfida berongga, laju evolusi hidrogen rata-rata bahan ini adalah 4,2 kali lebih tinggi daripada sulfida konvensional. Struktur berongga yang unik dapat sepenuhnya mengekspos situs aktif reaksi, dengan manfaat peningkatan penyerapan cahaya, menjadikan bahan ini kinerja evolusi hidrogen fotokatalitik yang sangat baik. [ 15 ]
CuS merupakan material yang populer di bidang evolusi hidrogen fotokatalitik karena pita serapan tambahannya di wilayah inframerah dekat (NIR) dan struktur semikonduktor tipe-p dengan celah pita sempit. Rekombinasi cepat pasangan elektron-lubang (eh) fotogenerasi CuS membatasi pengembangan dan aplikasi material semikonduktor yang menjanjikan ini. Konstruksi heterojunction antara CuS dan semikonduktor lain dapat secara efektif memecahkan masalah ini. Pada tahun 2024, Lian et al. [ 16 ] mengkonstruksi heterojunction pn dengan menggabungkan CuS dengan ZnIn 2 S 4 . Rekombinasi elektron dan lubang fotogenerasi telah dihambat secara efektif, menjadikan material tersebut memiliki kinerja evolusi hidrogen fotokatalitik yang sangat baik. Pada tahun yang sama, Zhao et al. [ 17 ] menggunakan CuS untuk mengkonstruksi heterojunction pn plasma untuk meningkatkan kinerja pemisahan air fotokatalitik secara keseluruhan yang didorong oleh cahaya inframerah. Oleh karena itu, CuS berongga dipilih sebagai pembawa untuk menyiapkan material komposit, yang dapat menyediakan lebih banyak lokasi aktif untuk reaksi sambil mempertahankan keunggulan CuS dalam penyerapan cahaya.
Sulfida logam yang berasal dari MOF merupakan bahan kandidat yang sangat baik untuk membangun fotokatalis heterojunction. [ 18 , 19 ] Sulfida logam transisi yang berasal dari MOF tidak hanya dapat mempertahankan susunan atom prekursor, tetapi juga menawarkan luas permukaan spesifik yang besar dan situs yang lebih reaktif, sehingga dapat meningkatkan reaksi. CuS berongga memiliki kemampuan penyerapan cahaya yang baik, dan kombinasi dengan sulfida yang berasal dari MOF dapat membangun heterostruktur, yang memungkinkan pemisahan elektron dan lubang yang dihasilkan secara efektif. Atom S yang digunakan bersama dapat meningkatkan interaksi antara dua bahan semikonduktor sambil membangun saluran transfer elektron, yang kondusif untuk transfer fotoelektron, meningkatkan laju penggunaan elektron yang dihasilkan secara foto. [ 20 , 21 ] Oleh karena itu, kami mengusulkan untuk menyiapkan fotokatalis komposit dengan struktur heterogen dengan menumbuhkan sulfida yang berasal dari MOF pada CuS berongga, sehingga dapat mewujudkan produksi hidrogen fotokatalitik yang efisien.
Di sini, CuS dengan struktur berongga (H-CuS) telah berhasil disiapkan dan dimuat dengan NiS 2 yang berasal dari MOF dan lembaran nano CuS. Produksi hidrogen fotokatalitik dari komposit H-CuS/NiS 2 @CuS dapat mencapai 17,66 mmol g −1 h −1 , dan masih memiliki kinerja evolusi hidrogen yang sangat baik setelah empat uji stabilitas siklus, yang menunjukkan bahwa material tersebut memiliki stabilitas siklus yang baik. Mekanisme dan perilaku kinetik fotokatalis ini dipelajari lebih lanjut oleh XPS dan serangkaian eksperimen fotokimia. Hasilnya menunjukkan bahwa mekanisme transfer elektron dari komposit adalah heterostruktur skema-S yang khas. Di bawah gaya medan listrik dari medan listrik antarmuka heterojunction skema-S (IEF), elektron terakumulasi dalam pita konduksi NiS 2 , yang membuatnya memiliki redusibilitas tinggi dalam HER, dan secara efektif meningkatkan efisiensi pemisahan pasangan eh. Penelitian ini menawarkan ide yang layak untuk sintesis fotokatalis heterojunction dengan kinerja evolusi hidrogen yang luar biasa.
2 Hasil dan Pembahasan
2.1 Struktur dan Karakterisasi Material
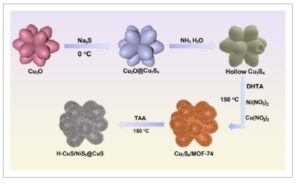
Pertama-tama kami mensintesis prekursor Cu 2 O 14-pod dengan metode solvotermal pada suhu 100 °C. Selanjutnya, Cu 2 O divulkanisasi untuk membentuk struktur inti-kulit Cu 2 O@Cu 7 S 4 menggunakan Na 2 S sebagai sumber sulfur pada suhu 0 °C. Komposit yang dihasilkan kemudian direndam dalam amonia selama 2 hari untuk melarutkan Cu 2 O di dalam untuk membentuk kulit Cu 7 S 4 dengan struktur berongga. [ 22 ] Kemudian, MOF-74 bimetalik ditumbuhkan pada permukaan Cu 7 S 4 berongga menggunakan metode solvotermal pada suhu 150 °C. [ 23 – 26 ] Akhirnya, komposit H-CuS/NiS 2 @CuS dibentuk dengan sulfurisasi lebih lanjut dengan tioasetamida pada suhu 150 °C. Pada material komposit, heterojunction skema-S dibangun. Bagan alir persiapan material diilustrasikan dalam Gambar 1. Untuk membuktikan integritas material yang disintesis, fotokatalis diuji masing-masing dengan FT-IR dan PXRD. Seperti yang diilustrasikan dalam Gambar S1 (Informasi Pendukung), prekursor Cu2O berhasil disintesis. [ 22 ] Seperti yang diilustrasikan dalam Gambar 2a , puncak difraksi Cu7S4 sangat cocok dengan kartu standar, yang membuktikan keberhasilan sintesis Cu7S4 . Setelah menumbuhkan MOF -74 bimetalik di atasnya, puncak difraksi Cu7S4 dan MOF-74 tidak melemah, yang menunjukkan bahwa Cu7S4 mempertahankan struktur kristal yang baik ketika dikombinasikan dengan MOF-74. [ 23 , 24 ] Seperti yang diilustrasikan dalam Gambar S2 (Informasi Pendukung), FT-IR menunjukkan bahwa puncak MOF-74 konsisten dengan yang dilaporkan dalam literatur . Setelah sulfurisasi dengan tioasetamida, puncak difraksi milik Cu7S4 menghilang , dan puncak difraksi milik CuS muncul seperti yang diilustrasikan pada Gambar 2b , yang menunjukkan bahwa selama sulfidasi Cu7S4 , Cu + dioksidasi menjadi Cu2 + dan selanjutnya disulfurisasi menjadi CuS . Puncak-puncak kecil pada 35 , 38, 45, 53, 58, dan 61 ° merupakan puncak difraksi NiS2 . [ 27 , 28 ]Berdasarkan hasil sebelumnya, komposit yang terdiri dari CuS dan NiS2 telah berhasil disintesis.
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
Ilustrasi skema prosedur sintesis H-CuS/NiS 2 @CuS. DHTA adalah asam 2,5-dihidroksitereftalat. TAA adalah tioasetamida.
Buka di penampil gambar
Kekuatan Gambar
a,b) Pola PXRD sampel.
Mikroskop elektron pemindaian (SEM), mikroskop elektron transmisi (TEM), dan spektrometer dispersif energi (EDS) digunakan untuk mengkarakterisasi morfologi, mikrostruktur, dan distribusi elemen dari fotokatalis yang disiapkan. Seperti yang diilustrasikan dalam Gambar 3a , prekursor Cu2O memiliki bentuk “tanaman sukulen” seperti 14 polong, dan permukaannya divulkanisasi untuk membentuk 14 cangkang Cu7S4 seperti polong . Seperti yang dapat dilihat dari Gambar 3b,c , Cu2O di dalam Cu7S4 akan membentuk kompleks dengan NH3 untuk melarutkan dirinya sendiri setelah direndam dalam air amonia, sehingga membentuk cangkang Cu7S4 dengan struktur berongga. MOF- 74 bimetalik Ni-Cu kemudian tumbuh pada Cu7S4 berongga ( Gambar 3d , e ). Setelah sulfurisasi dengan tioasetamida, material komposit H-CuS/NiS 2 @CuS dibentuk dengan NiS 2 dan lembaran nano CuS yang dilapisi pada permukaan CuS berongga 14-pod (Gambar 3f,g ). Mikrostruktur material diselidiki lebih lanjut oleh HRTEM. Gambar 3h menunjukkan antarmuka yang jelas antara CuS dan NiS 2 . Selain itu, jarak kisi 0,30 nm sesuai dengan muka kristal (102) CuS. [ 29 , 30 ] Dan jarak kisi 0,28 nm sesuai dengan muka kristal (200) NiS 2 . [ 31 , 32 ] Lebih jauh, spektrum EDS (Gambar 3i ) menunjukkan bahwa Cu, Ni, dan S terdistribusi secara seragam, yang selanjutnya menunjukkan keberhasilan sintesis komposit H-CuS/NiS 2 @CuS.

Gambar 3
Buka di penampil gambar
Kekuatan Gambar
a) Gambar SEM Cu 2 O. b) Gambar SEM Cu 7 S 4 berongga . c) Gambar TEM Cu 7 S 4 berongga . d,e) Gambar SEM Cu 7 S 4 /Ni-Cu MOF-74. f) Gambar SEM H-CuS/NiS 2 @CuS. g) Gambar TEM H-CuS/NiS 2 @CuS. h) Gambar HRTEM komposit. Gambar pemetaan unsur komposit. i) Spektrum EDS bahan komposit. Skala pada gambar (a,d,e,f, dan i) adalah 1 μm.
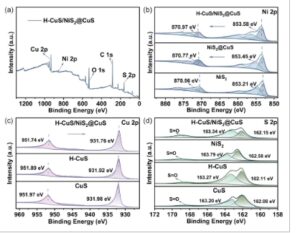
Untuk tujuan mempelajari konstituen dan keadaan valensi bahan yang difabrikasi, sampel H-CuS/NiS 2 @CuS dianalisis dengan XPS. Seperti dapat dilihat dari Gambar 4a , XPS dengan jelas menunjukkan puncak karakteristik Cu 2p, S 2p, Ni 2p, dan O 1s di seluruh rentang spektral. Seperti dapat diamati dari Gambar 4b,c , setelah pembentukan bahan komposit, energi pengikatan unsur -unsur Cu dan Ni mengalami sedikit pergeseran, yang menyiratkan bahwa ada gaya interaksi elektronik yang kuat antara CuS dan NiS 2. Dalam spektrum Ni 2p, ada dua puncak utama yang muncul pada 853,40 dan 870,84 eV, dan ini sejalan dengan Ni 2p 3/2 dan Ni 2p 1/2 untuk Ni 2+ . Dua puncak lainnya, yang diposisikan pada 855,34 dan 874,19 eV, sesuai dengan Ni 2p 3/2 dan Ni 2p 1/2 dari Ni 3+ . [ 33 , 34 ] Selain itu, kami juga mengamati puncak satelit Ni pada 859,23 dan 876,88 eV, dan spektrum menunjukkan bahwa Ni terutama ada dalam bentuk valensi Ni 2+ dan Ni 3+ . Setelah pembentukan material komposit, energi ikat elemen Ni memiliki pergeseran positif, yang menunjukkan bahwa kerapatan elektron pada permukaan NiS 2 berkurang, dan elektron ditransfer keluar dari NiS 2 . Dalam spektrum XPS Cu 2p, dua puncak yang energi pengikatannya adalah 931,76 dan 951,74 eV terlihat, sesuai dengan Cu 2p 3/2 dan Cu 2p 1/2 dari Cu 2+ , yang menunjukkan bahwa Cu ada dalam bentuk valensi Cu 2+ . [ 35 , 36 ] Setelah pembentukan material komposit, energi pengikatan unsur Cu memiliki pergeseran negatif, yang menunjukkan bahwa kerapatan elektron pada permukaan H-CuS dan CuS meningkat dan elektron ditransfer ke keduanya. [ 37 , 38 ] Hasil awal menunjukkan bahwa setelah H-CuS, CuS, dan NiS 2 digabungkan, kerapatan elektron pada permukaan material berubah, dan elektron ditransfer dari NiS 2 ke H-CuS dan CuS. Selain itu, spektrum S 2p menunjukkan dua puncak, satu pada 163,34 eV dan yang lainnya pada 162,15 eV (Gambar 4d ), dan puncak-puncak ini sesuai dengan S 2p 3/2 dan S 2p 1/2 sedangkan puncak yang lebih kecil pada 168,87 eV merupakan ikatan SO, yang merupakan hasil oksidasi permukaan sulfida. [ 39 ,40 ]Analisis XPS tersebut menunjukkan bahwa setelah persiapan komposit berhasil, elektron pada NiS2ditransfer ke H-CuS dan CuS.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
a) Spektrum penuh XPS dari H-CuS/NiS 2 @CuS. b) Spektrum XPS Ni 2p. c) Spektrum XPS Cu 2p. d) Spektrum XPS S 2p.
2.2 Kinerja Fotokatalitik Bahan
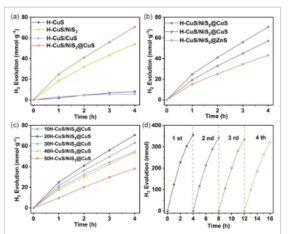
Percobaan HER dilakukan dengan menggunakan Eosin Y (EY) sebagai fotosensitizer dan trietanolamin sebagai agen pengorbanan. Percobaan evolusi hidrogen dilakukan dalam kondisi cahaya tampak ( λ > 420 nm) ( Gambar 5a ) . Laju di mana H-CuS/NiS 2 @CuS mengembangkan hidrogen dapat mencapai 17,66 mmol g −1 h −1 (AQE = 6,77%, λ = 475 nm), yang lebih unggul daripada H-CuS dan komposit yang terbentuk setelah vulkanisasi logam tunggal MOF-74. Kemudian, kami menguji komposit setelah MOF-74 bimetalik yang berbeda tumbuh ke Cu 7 S 4 dan vulkanisasi. Dapat dilihat dari Gambar 5b bahwa komposit yang dibentuk oleh pemuatan MOF-74 bimetalik Ni Cu dan vulkanisasi memiliki sifat tertinggi dalam evolusi hidrogen fotokatalitik. Akhirnya, kami menjaga konten MOF-74 tidak berubah, menyesuaikan proporsi komponen sulfida yang berbeda dengan mengubah jumlah bahan matriks Cu7S4 , dan menguji kinerja evolusi hidrogennya. Seperti yang diilustrasikan dalam Gambar 5c , sifat bahan dalam evolusi hidrogen fotokatalitik secara bertahap membaik saat jumlah bahan matriks berkurang, dan laju evolusi hidrogen mencapai maksimumnya saat jumlah Cu7S4 dikurangi menjadi 20 mg. Setelah empat pengujian produksi hidrogen, katalis H-CuS/NiS2 @CuS mempertahankan efisiensi produksi hidrogen sebesar 89% dibandingkan dengan siklus pertama (Gambar 5d ), yang menunjukkan stabilitas evolusi hidrogen fotokatalitik yang sangat baik dari komposit tersebut .
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
a) Laju evolusi H 2 dari bahan-bahan yang dibebani logam tunggal MOF-74 setelah vulkanisasi. b) Laju evolusi H 2 dari bahan-bahan yang dibebani bimetal MOF-74 yang berbeda (Ni-Cu MOF-74, Ni-Co MOF-74, Ni-Zn MOF-74) setelah vulkanisasi. c) Laju evolusi H 2 dengan beban yang berbeda. d) Uji stabilitas H-CuS/NiS 2 @CuS.
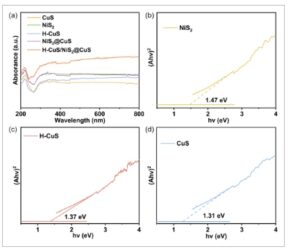
UV-Vis DRS digunakan untuk menyelidiki struktur pita fotokatalis H-CuS/NiS 2 @CuS. Seperti yang diilustrasikan dalam Gambar 6a , sulfida logam transisi menunjukkan penyerapan cahaya yang kuat di seluruh rentang tampak. Dibandingkan dengan sulfida tunggal, laju penyerapan cahaya tampak dari bahan komposit telah ditingkatkan lebih jauh, yang menguntungkan untuk HER fotokatalitik. Lebih jauh lagi, celah pita bahan tersebut selanjutnya diperhitungkan dari spektrum UV-Vis DRS semikonduktor dengan menggunakan pendekatan Kubelka–Munk. [ 41 , 42 ] Seperti yang diilustrasikan dalam Gambar 6b–d , nilai celah pita H-CuS, CuS, dan NiS 2 masing-masing adalah 1,37, 1,31, dan 1,47 eV. Nilai celah pita H-CuS/NiS 2 @CuS lebih kecil daripada NiS 2 (Gambar S3, Informasi Pendukung), yang berarti bahan komposit lebih mudah tereksitasi oleh cahaya dan menghasilkan lebih banyak elektron dan lubang yang diinduksi foto, sehingga meningkatkan sifat fotokatalitik bahan tersebut.
Gambar 6
Buka di penampil gambar
Kekuatan Gambar
a) Spektrum UV-Vis DRS dari sampel. b–d) Celah pita optik untuk NiS 2 , H-CuS, dan CuS. (Garis horizontal berwarna pada (b–d) mewakili garis dasar Y = 0).
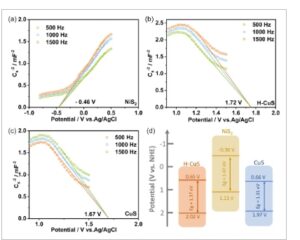
Untuk tujuan memperoleh struktur pita material, kami melakukan uji Mott–Schottky pada material yang disintesis, seperti yang diilustrasikan pada Gambar 7 a–c . Potensi pita datar (V FB ) dari H-CuS, CuS, dan NiS 2 dihitung. Nilainya adalah 1,72 V versus Ag/AgCl (=1,92 V versus NHE) untuk H-CuS, 1,67 V versus Ag/AgCl (=1,87 V versus NHE) untuk CuS, dan −0,46 V versus Ag/AgCl (=−0,26 V versus NHE) untuk NiS 2 , masing-masing, yang menunjukkan bahwa H-CuS dan CuS adalah semikonduktor tipe-p sementara NiS 2 adalah semikonduktor tipe-n. Potensi pita valensi (V VB ) semikonduktor tipe-p biasanya dinaikkan sebesar 0,1 hingga 0,2 V jika dibandingkan dengan potensi pita datar, dan potensi pita konduksi (V CB ) semikonduktor tipe-n biasanya lebih rendah sebesar 0,1 hingga 0,2 V jika dibandingkan dengan potensi pita datar. Akibatnya, V VB H-CuS, CuS, dan V CB NiS 2 masing-masing adalah 2,02, 1,97, dan −0,36 V (relatif terhadap NHE). [ 43 – 46 ] Oleh karena itu, struktur pita material diilustrasikan dalam Gambar 7d . Hasil pengujian di atas dalam bagan Mott–Schottky menunjukkan bahwa NiS 2 menyajikan kemiringan positif sementara H-CuS dan CuS menyajikan kemiringan negatif. Kedua material ini memiliki struktur pita yang sesuai, dan konstruksi IEF dapat secara efektif memisahkan pasangan eh. Lebih jauh lagi, mekanisme transfer muatan konsisten dengan heterojunction skema-S, yang membuat HER fotokatalitik berlangsung secara efisien.
Gambar 7
Buka di penampil gambar
Kekuatan Gambar
a–c) Plot Mott–Schottky untuk NiS 2 , H-CuS, dan CuS. d) Struktur pita untuk NiS 2 , H-CuS, dan CuS.
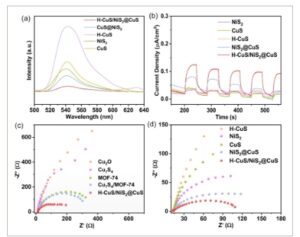
Untuk mempelajari kemampuan pemisahan fotoelektron dan lubang dalam fotokatalis, kami menguji spektrum PL material tersebut. Seperti yang diilustrasikan dalam Gambar 8a , di bawah kondisi pengujian dengan panjang gelombang eksitasi 380 nm, semua sampel menunjukkan puncak luminesensi yang jelas pada 541 nm. Penurunan intensitas puncak menunjukkan peningkatan efisiensi dalam pemisahan pasangan eh, yang juga menunjukkan aktivitas fotokatalitik katalis yang lebih baik. Dapat dilihat dari gambar bahwa sulfida tunggal memiliki puncak luminesensi yang kuat, dan nilai puncak komposit yang diperoleh dengan memvulkanisasi Ni-Cu MOF-74 berkurang secara signifikan, sedangkan nilai puncak komposit yang diperoleh dengan memvulkanisasi bimetalik MOF-74 pada Cu7S4 berkurang lebih jauh. Konstruksi heterojunction yang berhasil secara efektif memisahkan pasangan eh yang dihasilkan oleh fotoeksitasi. Di antara semua katalis komposit yang diselidiki, H-CuS/NiS2 @ CuS menunjukkan puncak PL terendah. Hal ini sesuai dengan kinerja produksi hidrogen yang optimal. Lebih lanjut ditunjukkan bahwa pembentukan heterojunction H-CuS/NiS 2 @CuS mampu mengurangi rekombinasi pasangan eh dan secara substansial meningkatkan sifat produksi hidrogen dari fotokatalis.
Gambar 8
Buka di penampil gambar
Kekuatan Gambar
a) Spektrum PL dengan EY. b) Respon arus foto transien. c,d) Spektrum impedansi elektrokimia dari bahan sulfida tunggal, bahan komposit, dan prekursornya.
Kami memantau variasi kerapatan arus foto dari waktu ke waktu seperti yang diilustrasikan pada Gambar 8b . Terlihat bahwa respons arus foto transien komposit jauh lebih tinggi daripada sulfida tunggal. Di antara keduanya, material H-CuS/NiS 2 @CuS memiliki kerapatan arus foto maksimum. Respons yang lebih kuat ini dapat dikaitkan dengan interaksi yang erat antara H-CuS, CuS, dan NiS 2 . Interaksi semacam ini meningkatkan transfer muatan dan mengurangi rekombinasi pasangan eh. Kami menggunakan EIS untuk menyelidiki resistansi transfer muatan. Seperti yang diilustrasikan pada Gambar 8c,d , sulfida logam transisi menunjukkan impedansi yang relatif kecil. Plot Nyquist untuk H-CuS/NiS 2 @CuS menunjukkan setengah lingkaran terkecil, yang menunjukkan bahwa H-CuS/NiS 2 @CuS memiliki impedansi yang lebih kecil daripada prekursornya dan sulfida tunggal, yang mendukung transfer muatan fotogenik.
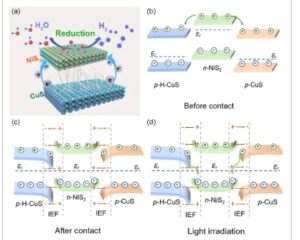
Mekanisme proses fotokatalitik ini dapat diringkas secara ringkas sebagai berikut: NiS 2 adalah semikonduktor tipe-n, dan H-CuS dan CuS adalah semikonduktor tipe-p, dengan perbedaan signifikan dalam level Fermi-nya. Setelah pembentukan komposit, elektron dalam NiS 2 secara otomatis telah ditransfer ke H-CuS dan CuS karena perbedaan energi Fermi ( Gambar 9 a ). Hasilnya sejalan dengan analisis XPS. Pada akhirnya, level Fermi mereka mulai konvergen. [ 39 , 47 ] Seperti yang diilustrasikan dalam Gambar 9b , pita energi H-CuS, CuS, dan NiS 2 masing-masing tertekuk karena akumulasi elektron dan hilangnya elektron. Secara bersamaan, medan listrik internal telah dibangun di antarmuka bahan komposit. [ 44 , 48 , 49 ] Setelah diekspos pada iradiasi cahaya tampak, fotokatalis H-CuS/NiS 2 @CuS tereksitasi, menghasilkan pembentukan pasangan elektron-lubang. Berdasarkan efek gabungan dari pembengkokan pita, IEF dan tolakan Coulomb, beberapa lubang di V VB NiS 2 bergabung kembali dengan elektron di V CB H-CuS dan CuS di bawah pengaruh IEF, menghasilkan kumpulan fotoelektron di V CB NiS 2 (Gambar 9c ). Akibatnya, elektron yang tertahan di dalam NiS 2 menunjukkan daya reduksi yang tinggi dan dapat mengkatalisis disosiasi air menjadi hidrogen. [ 37 , 50 ] H-CuS dan CuS mengumpulkan lebih banyak lubang di V VB , yang secara signifikan meningkatkan efisiensi pemisahan pasangan eh. Mekanisme transfer elektron dalam komposit ini sejalan dengan heterojunction skema-S standar. Secara bersamaan, EY tereksitasi foto dan ditransmutasikan ke dalam keadaan tereksitasi EY 1* . Melalui persilangan antarsistem, EY 1* diubah menjadi keadaan tereksitasi triplet yang lebih stabil EY 3* . [ 51 , 52 ] Agen pengorbanan TEOA menangkap lubang pada CuS, dan TEOA dioksidasi menjadi TEOA + , sehingga memfasilitasi konversi EY 3* menjadi EY − . [ 53 , 54 ] Elektron yang dihasilkan oleh EY ditransfer ke V CB dari NiS 2 , yang menggabungkan elektron pada VCB dari NiS 2 .
Gambar 9
Buka di penampil gambar
Kekuatan Gambar
a) Diagram dekomposisi air fotokatalitik suatu sampel. b–d) Mekanisme reaksi fotokatalitik sampel.
3 Kesimpulan
Singkatnya, MOF-74 bimetalik ditumbuhkan pada Cu7S4 berongga dengan metode solvotermal. Selanjutnya, setelah divulkanisasi, komposit H-CuS/NiS2 @ CuS diperoleh. H-CuS/NiS2 @ CuS menunjukkan tingkat aktivitas yang unggul dalam fotokatalitik HER. H-CuS/NiS2 @ CuS (bahan dasar 20 mg) memiliki sifat fotokatalitik HER yang paling baik, dan laju evolusi hidrogen mencapai 17,66 mmol g −1 h −1 , secara signifikan lebih tinggi daripada sulfida logam transisi tunggal. Aktivitas HER masih tinggi setelah 4 siklus. Selain itu, hasil pengujian menunjukkan bahwa H-CuS dan CuS adalah semikonduktor tipe-p, NiS2 adalah semikonduktor tipe-n, dan mekanisme transfer elektron konsisten dengan heterojunction skema-S. Dalam heterojunction skema-S, IEF menyebabkan fotoelektron terakumulasi pada V CB NiS 2 , yang membuat NiS 2 sangat dapat direduksi dalam HER, yang secara efektif memisahkan elektron yang dihasilkan foto dan pasangan lubang. Penelitian ini menawarkan landasan teoritis untuk menganalisis prinsip IEF dalam heterojunction skema-S dan juga membuka jalur baru untuk konstruksi heterojunction dalam sintesis fotokatalis yang sangat aktif.

