
Abstrak Grafis
Tinjauan ini memberikan gambaran menyeluruh tentang kemajuan terkini dalam pengembangan katalis, pengaturan eksperimen, dan metode analitis untuk oksidasi gliserol elektrokimia. Penekanan diberikan pada tantangan dalam memahami mekanisme reaksi dan pentingnya standarisasi pelaporan data dan metodologi untuk pengukuran elektrokimia dan analisis produk guna meningkatkan reproduktifitas di seluruh studi.
Abstrak
Oksidasi elektrokimia gliserol menyajikan strategi untuk memanfaatkan produk sampingan gliserol dari produksi biodiesel guna menghasilkan produk cair yang berharga di anoda dan hidrogen hijau di katoda, dengan kebutuhan energi yang lebih rendah daripada elektrolisis air konvensional, yang menawarkan manfaat lingkungan dan ekonomi. Tinjauan ini merangkum kemajuan terkini dalam pengembangan elektrokatalis untuk elektrooksidasi gliserol dan menyoroti tantangan yang ditimbulkan oleh mekanisme reaksinya yang kompleks, termasuk distribusi produk yang luas, berbagai konfigurasi pengikatan spesies reaksi, zat antara yang tidak stabil, dan koeksistensi jalur Faradaik dan non-Faradaik, yang semuanya mempersulit identifikasi dan kuantifikasi turunan gliserol menggunakan teknik kromatografi dan spektroskopi. Tinjauan ini menekankan perlunya menetapkan protokol standar untuk pengukuran elektrokimia yang dapat diskalakan dan dipindahkan dari elektroda cakram berputar (RDE) ke rakitan elektroda membran (MEA), serta untuk deteksi dan kuantifikasi produk menggunakan kromatografi cair kinerja tinggi (HPLC). Untuk memungkinkan perbandingan intra-laboratorium, peneliti harus memberikan spesifikasi terperinci tentang pengaturan, kondisi, dan metodologi eksperimental untuk mengevaluasi aktivitas elektrokimia, ketahanan katalis, dan standar kalibrasi untuk kuantifikasi produk melalui HPLC. Konsistensi dalam pelaporan data eksperimental, khususnya mengenai selektivitas produk, sangat penting tetapi sering diabaikan. Terakhir, makalah ini membahas potensi penerapan teknik in situ untuk memahami mekanisme reaksi pada tingkat molekuler dan untuk membedakan antara jalur reaksi Faradaik dan non-Faradaik, sambil membahas keterbatasan dan kesulitan penerapan teknik ini.
1 Pendahuluan
Gliserol (C3H8O3 ) adalah poliol tiga karbon yang banyak digunakan dalam makanan dan farmasi dan berfungsi sebagai molekul platform yang penting. Gliserol adalah produk sampingan dari produksi biodiesel melalui transesterifikasi trigliserida, di mana 1 m3 gliserol diproduksi per 9 m3 biodiesel . Meningkatnya produksi biodiesel ( diperkirakan sebesar 40 juta ton per tahun dari tahun 2024 hingga 2027) telah menyebabkan kelebihan pasokan gliserol kadar rendah (diproyeksikan sebesar 680.000 ton pada tahun 2024), [ 1 ] melampaui permintaan dan kapasitas penyimpanan, yang menyebabkan devaluasi komersial dan pembuangan gliserol tanpa pemanfaatan penuh. Gliserol mentah dari biodiesel biasanya mengandung berbagai kontaminan, seperti asam lemak, sabun, metanol, dan jejak logam dari katalis, dengan kemurnian gliserol rendah sebesar 30%–60%. Untuk memanfaatkan gliserol mentah yang tidak murni ini, pemurnian biasanya dilakukan dengan distilasi vakum, yang memerlukan biaya besar. [ 1 – 3 ]
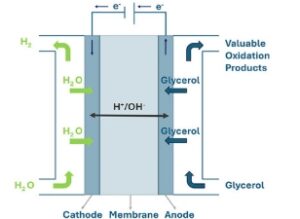
Upaya baru-baru ini telah bergeser ke arah upcycling gliserol melalui konversi elektrokimia dalam kondisi operasi ringan, [ 4 – 6 ] sebagai lawan dari pendekatan termal yang intensif energi. [ 2 , 7 – 9 ] Gliserol teroksidasi pada potensial yang jauh lebih rendah daripada air (potensial kesetimbangan standar, E 0 = 1,23 V RHE ), [ 10 ] dengan deprotonasi gliserol terjadi pada potensial serendah 0,23 V RHE dan 0,32 V RHE pada kondisi referensi standar (yaitu, suhu standar (T = 298,15 K) dan tekanan (p = 1 bar)) untuk membentuk gliseraldehida dan dihidroksiaseton, masing-masing, seperti yang ditunjukkan pada Tabel 1 . [ 10 ] Jalur reaksi terperinci yang mengarah ke turunan gliserol yang tercantum dalam Tabel 1 dibahas dalam Bagian 2.2 . Oleh karena itu, oksidasi gliserol elektrokimia dapat menggantikan reaksi evolusi oksigen (OER) dan digabungkan dengan reaksi reduksi katoda seperti reaksi evolusi hidrogen (HER), [ 11 – 15 ] Gambar 1a,b . Pendekatan ini menawarkan strategi untuk kogenerasi produk cair yang berharga di anoda, yang laju dan selektivitas produknya dikendalikan oleh potensial elektroda, dan hidrogen hijau di katoda dengan konsumsi energi yang lebih rendah dibandingkan dengan elektrolisis air konvensional, memberikan manfaat lingkungan dan ekonomi. [ 16 ] Selain itu, elektro-oksidasi gliserol telah diusulkan sebagai reaksi anodik potensial yang dipasangkan dengan reduksi CO 2 elektrokimia alih-alih OER, [ 17 – 23 ] memanfaatkan CO 2 untuk menghasilkan bahan kimia karbon, seperti CO, metana, dan format, di katoda, sambil mengurangi permintaan listrik hingga 50%.
Tabel 1. Persamaan reaksi evolusi oksigen dan reaksi oksidasi gliserol dengan potensial kesetimbangan standar.

Sumber data: Ref. [ 10 ] dihitung berdasarkan data termodinamika yang tersedia (energi bebas Gibbs dan entalpi pembentukan dan reaksi) yang diambil dari database RMG [ 24 ] dan database National Institute of Standards and Technology (NIST). [ 25 ]

Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
(a) Skema sistem elektrolisis gliserol, (b) termodinamika dan kinetika untuk elektrolisis air dan elektrolisis gliserol, dan (c) skema rakitan elektroda membran (gambar dibuat ulang dari bahan dioksida) yang berisi pelat bipolar anoda dan katoda, elektroda, membran pertukaran anion/proton, dan paking pemisah.
Selama beberapa dekade terakhir, beberapa studi menyelidiki penggunaan sel rakitan elektroda membran (MEA), seperti yang diilustrasikan dalam Gambar 1c , untuk menggabungkan reduksi air dengan elektrooksidasi gliserol. Sistem ini menggunakan material berbasis logam golongan platina (PGM) (1–2 mg PGM cm −2 ) sebagai anoda dan Pt/C (≤1 mg Pt cm −2 ) sebagai katoda. [ 26 , 27 ] Chen dkk. [ 28 ] menunjukkan bahwa elektrolisis alkohol yang berasal dari biomassa dapat lebih menguntungkan daripada elektrolisis air karena kogenerasi hidrogen dan produk cair yang berharga. Selain itu, Kim dkk. [ 29 ] melaporkan bahwa proses oksidasi gliserol elektrokatalitik pada potensial terapan 1,1 V RHE menghasilkan rendemen gliseraldehida, asam gliserat, dan asam hidroksipiruvat ~1,7 kali lebih tinggi daripada yang dicapai melalui proses non-elektrokatalitik pada tekanan oksigen 100 psia. Selain itu, harga jual minimum asam gliserat untuk proses elektrokatalitik adalah setengah ($2,30/kg) dari proses non-elektrokatalitik ($4,91/kg). Oksidasi gliserol elektrokatalitik dapat terjadi dalam satu reaktor, tanpa memerlukan oksidan stoikiometris, seperti O2 atau H2O2 , yang membantu mengurangi biaya operasi dibandingkan dengan reaktor katalitik heterogen konvensional. Mempertimbangkan biaya operasi dan pendapatan dari produk oksidasi selektif di anoda dan hidrogen di katoda, oksidasi gliserol elektrokatalitik menunjukkan kelayakan ekonomi dan potensi untuk adopsi industri .
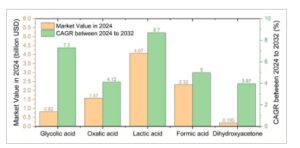
Bahasa Indonesia: Meskipun kelayakan ekonominya, oksidasi gliserol parsial dan nonselektif tidak diinginkan dan dapat menyebabkan campuran kompleks dari banyak zat antara dan produk, [ 30 ] yang memerlukan pemurnian mahal di hilir. Untuk mengatasi hal ini, pengembangan elektrokatalis harus fokus pada peningkatan selektivitas untuk memaksimalkan konversi gliserol menuju satu produk yang bernilai untuk aplikasi industri, sambil meminimalkan pembelahan ikatan C─C dan menghindari oksidasi lengkap menjadi CO 2 . Produk C2 dan C3, seperti asam laktat, asam oksalat, dan asam glikolat, serta produk C1 asam format, telah ditargetkan sebagai produk yang menarik bagi para peneliti karena nilai pasarnya yang tinggi dan potensi pertumbuhan pasar, seperti yang dapat dilihat pada Gambar 2 , yang menggambarkan nilai pasar dan tingkat pertumbuhan tahunan yang diproyeksikan untuk produk bernilai tambah dari oksidasi gliserol. Di antara produk-produk tersebut, produk C3, khususnya asam laktat, memiliki harga pasar tertinggi sebesar 4,07 miliar USD pada tahun 2024 dan diproyeksikan akan tumbuh pada tingkat 8,7% per tahun antara tahun 2024 hingga 2032. Senyawa C2 seperti asam glikolat juga menunjukkan proyeksi pertumbuhan yang tinggi sebesar 7,3%, meskipun nilai pasarnya rendah yaitu 0,82 miliar USD. Senyawa C1, asam format, menunjukkan nilai yang pas-pasan sebesar 2,32 miliar USD dengan tingkat pertumbuhan 5% per tahun.
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
Ukuran pasar dan tingkat pertumbuhan tahunan gabungan (CAGR) untuk produk oksidasi gliserol. Sumber data: Riset presedensi untuk asam format, asam oksalat, dan asam laktat. Wawasan bisnis Fortune untuk asam glikolat. Wawasan pertumbuhan global untuk dihidroksiaseton.
Selain itu, pengembangan elektrokatalis harus didukung oleh metode yang andal untuk mengevaluasi kinerja elektrokimia seperti kerapatan arus dan ketahanan katalis, yang dapat diskalakan dan ditransfer ke sistem skala MEA. Namun, saat ini terdapat kekurangan protokol standar, dan keandalan metode karakterisasi jarang dibahas dalam literatur.
Dalam makalah ini, kami menguraikan kemajuan terkini, dan tantangan yang saat ini dihadapi di bidang elektrooksidasi gliserol. Kami mulai dengan meringkas elektrokatalis mutakhir yang dikembangkan selama beberapa dekade terakhir, bersama dengan mekanisme reaksi yang didalilkan yang menghasilkan berbagai produk. Selanjutnya, kami menekankan kebutuhan kritis akan konsistensi dalam pelaporan data dan untuk pembentukan protokol standar untuk pengukuran elektrokimia dalam konfigurasi tiga elektroda dan dua elektroda, serta untuk deteksi dan kuantifikasi produk melalui teknik kromatografi dan spektroskopi. Akhirnya, kami membahas potensi teknik in situ untuk memberikan wawasan tentang mekanisme reaksi pada tingkat molekuler dan membedakan antara jalur reaksi Faradaik dan non-Faradaik, sementara juga membahas keterbatasan dan kesulitan dalam menerapkan teknik ini karena adanya beberapa produk reaksi dan mode pengikatan kompleks zat antara.
2 Kemajuan Terbaru pada Oksidasi Elektrokimia Gliserol
2.1 Elektrokatalis Tercanggih
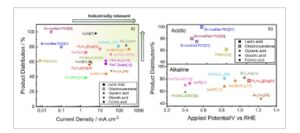
Logam mulia, terutama platinum dan emas, tetap menjadi elektrokatalis acuan untuk oksidasi alkohol elektrokimia karena kinerja kinetiknya yang luar biasa dan overpotensial yang rendah. [ 32 – 38 ] Berbagai strategi telah digunakan untuk merekayasa elektrokatalis yang sangat aktif dan tahan lama dengan beban PGM minimal, termasuk sintesis nanomaterial dengan berbagai bentuk dan struktur, [ 39 ] paduan bimetalik dan trimetalik, [ 40 – 42 ] katalis logam mulia yang dimodifikasi adatom, [ 43 – 45 ] atau penggabungan pendukung katalis fungsional. [ 15 ] Gambar 3 menyajikan aktivitas bahan katalis yang dilaporkan dalam literatur untuk oksidasi gliserol elektrokimia, beserta distribusi produk optimalnya pada potensial terapan spesifik dan kerapatan arus yang dapat dicapai. Tabel 2 mencantumkan informasi untuk bahan substrat tempat katalis ini, sebagaimana dirangkum dalam Gambar 3 , diendapkan atau ditumbuhkan, beserta kondisi operasinya, pengaturan eksperimen, dan distribusi produk. Dalam studi yang dikutip, reaksi katoda biasanya melibatkan reduksi air untuk menghasilkan hidrogen dan juga dapat mencakup reduksi produk oksidasi gliserol. Hal ini khususnya relevan ketika elektroda lawan (biasanya Pt atau grafit) dan elektroda kerja tidak dipisahkan oleh membran, seperti dalam konfigurasi tiga elektroda satu kompartemen. Distribusi produk sebagian besar ditentukan oleh HPLC, kecuali untuk studi oleh Li et al., [ 46 ] yang menggunakan spektrometer NMR. Meskipun, tidak semua studi yang dirujuk melaporkan metodologi HPLC mereka, metode yang tersedia telah disusun dalam Tabel 4 .
Gambar 3
Buka di penampil gambar
Presentasi PowerPoint
Ringkasan aktivitas katalitik dan hasil produk optimal untuk elektrokatalis yang dilaporkan dalam literatur: (a) Distribusi produk menggunakan berbagai elektrokatalis dan kerapatan arus yang sesuai. (b) Distribusi produk menggunakan berbagai elektrokatalis dan potensi yang diterapkan. *Pengukuran dilakukan dengan kronopotensiometri dengan rentang potensi yang bervariasi. [ 12 , 15 , 31 ] Distribusi produk dihitung menggunakan persamaan untuk = (mol produk cair X)/(mol total produk cair yang terdeteksi) × 100%, yang merupakan metode untuk melaporkan selektivitas di sebagian besar makalah yang tercantum. Singkatan: CNT = karbon nanotube; NF = Busa nikel; DPPE = oktakarbonil terkobalt dan 1,2-bis(difenilfosfino)etana. Referensi dipilih berdasarkan ketahanan metodologi analitis dan elektrokimia dalam mengevaluasi kinerja katalitik, daya tahan, dan analisis produk, serta relevansi dan keterbandingannya dengan penelitian elektrooksidasi gliserol yang lebih luas.
Tabel 2. Ringkasan katalis yang digunakan untuk oksidasi gliserol elektrokimia dalam elektrolit berair, termasuk substratnya yang sesuai, kondisi operasi, pengaturan eksperimen, dan distribusi produk.
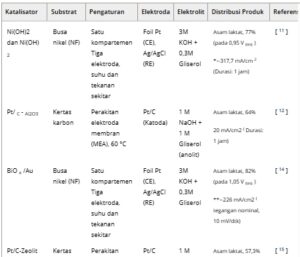
Nilai kerapatan arus tanpa tanda * diambil langsung dari pengukuran Galvano-statis, nilai dengan tanda * berasal dari kronoamperometri, dan kerapatan arus dengan tanda ** menunjukkan nilai yang diambil dari voltametri siklik atau voltametri sapuan linier pada potensial tempat distribusi produk diambil. CE = Elektroda lawan, RE = Elektroda referensi, dan substrat yang dimuat katalis berfungsi sebagai elektroda kerja.
Bahan substrat juga memengaruhi kinerja katalis. Katalis yang dilapisi atau tumbuh pada substrat yang berbeda, seperti jenis busa konduktif (misalnya, Ni, Cu, Fe, atau C) atau substrat planar halus seperti karbon kaca, menunjukkan kinerja yang bervariasi yang disebabkan oleh ketebalan, kepadatan, porositas, dan kemurnian bahan elektroda yang berbeda. Zheng et al. [ 47 ] menguraikan praktik terbaik dalam menggunakan substrat jenis busa untuk pemisahan air, memberikan saran untuk pengaturan eksperimen dan membahas masalah dalam normalisasi kerapatan arus dan evaluasi luas permukaan. Mereka menekankan pentingnya mengklarifikasi metode fabrikasi, karena variasi ketebalan yang dapat memengaruhi penentuan luas permukaan aktif elektrokimia (ECSA), dan jejak pengotor dapat mempengaruhi kinerja elektrokimia secara negatif. Temuan ini menggarisbawahi pentingnya komposisi katalis dan pilihan substrat untuk mengoptimalkan kinerja elektrooksidasi gliserol dalam aplikasi industri.
Bahan yang paling relevan secara industri yang dapat mencapai kerapatan arus >200 mA cm −2 , seperti yang dirangkum dalam Gambar 3a , adalah bahan berbasis Au dan Pt, dan paduannya. [ 40 , 41 , 46 , 48 , 49 ] Katalis berbasis Au telah menunjukkan aktivitas yang sangat baik dalam kondisi basa. Misalnya, Yan et al. [ 14 ] mengembangkan katalis Au yang dimodifikasi dengan lapisan nano BiOx dan mencapai selektivitas asam laktat yang tinggi sebesar 82% pada kerapatan arus 226 mA cm −2 pada 1,05 V RHE . Nanopartikel Au yang didukung pada CeO 2-x yang dilaporkan oleh Huang et al. [ 50 ] mencapai selektivitas asam laktat yang lebih tinggi (81%) pada 0,83 V RHE dibandingkan dengan Au monometalik dengan kerapatan arus sekitar 100 mA cm −2 .
Meskipun logam mulia memiliki sifat katalitik yang unggul, biaya tinggi dan kelangkaannya secara signifikan menantang aplikasinya. Banyak penelitian telah difokuskan pada pengembangan alternatif yang hemat biaya dan berlimpah di bumi, seperti kobalt, [ 31 , 58 ] nikel, [ 59 – 62 ] dan tembaga, [ 57 ] untuk menggantikan katalis logam mulia. Brix dkk. [ 60 ] menyelidiki nikel borida untuk mengatur pembentukan asam laktat. Oksida tembaga telah dipelajari sebagai elektrokatalis untuk elektrooksidasi gliserol menjadi dihidroksiaseton (60%) pada rapat arus 3 mA cm −2 dalam kondisi agak basa pH 9. [ 57 ] Namun, kinerjanya memerlukan potensial tinggi 2,06 V RHE , yang menyebabkan persaingan antara oksidasi gliserol dan oksidasi air, membuatnya kurang kompetitif dibandingkan dengan katalis logam mulia, yang dapat mencapai rapat arus lebih tinggi pada potensial di bawah 1,2 V RHE .
2.2 Mekanisme Reaksi
Gambar 4 menunjukkan keseluruhan jalur reaksi untuk oksidasi gliserol. Pada skala molekuler, oksidasi gliserol elektrokimia dimulai dengan penyerapan gliserol, diikuti oleh transfer elektron, reaksi dengan spesies teroksigenasi, dan akhirnya desorpsi produk. Langkah-langkah ini terkait erat dengan kimia katalis, komposisi permukaan katalis, pH, konsentrasi elektrolit, dan suhu, yang semuanya memengaruhi mekanisme reaksi dan pembentukan berbagai produk. [ 32 ] Beberapa langkah melibatkan transformasi kimia. Misalnya, dihidroksiaseton berlangsung melalui dehidrasi non-Faradaic (jalur Hijau pada Gambar 4 ) untuk menghasilkan 2-hidroksipropanal, yang ditautomerisasi menjadi piruvaldehida. Piruvaldehida kemudian berubah menjadi asam laktat melalui penataan ulang Cannizzaro.
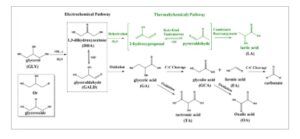
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Jalur reaksi untuk elektrooksidasi gliserol, yang terdiri dari jalur elektrokimia (hitam) dan jalur termal-kimia (hijau). Direproduksi dengan izin dari Ref. [ 32 ] berdasarkan ketentuan Copyright Clearance Center, Inc. (“CCC”). Hak cipta 2018, Elsevier.
Efek jenis katalis dan struktur permukaan : Gambar 5 merangkum berbagai mode adsorpsi gliserol pada permukaan katalis. Li et al. [ 5 ] memberikan tinjauan komprehensif tentang mekanisme elektro-oksidasi gliserol pada platinum, emas dan paladium, mengkategorikan jalur reaksi menjadi 1) O-adsorpsi, yang terjadi pada overpotensial yang lebih tinggi melalui koordinasi elektron pasangan elektron bebas pada oksigen hidroksil, dan 2) C-adsorpsi, jalur dominan pada overpotensial yang lebih rendah. Adsorbat yang terbentuk melalui C-adsorpsi dianggap lebih stabil daripada yang terbentuk melalui O-adsorpsi.
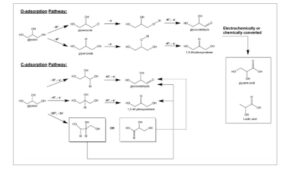
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Mekanisme adsorpsi yang berbeda pada logam mulia, di mana M mewakili permukaan katalis logam. Direproduksi dari Ref. [ 5 , 67 ] berdasarkan ketentuan Copyright Clearance Center, Inc. (”CCC”). Hak cipta 2021, John Wiley and Sons 5 ; hak cipta 2011, John Wiley and Sons. 67
Studi DFT baru-baru ini menunjukkan bahwa logam yang berbeda menunjukkan afinitas yang berbeda untuk adsorpsi gliserol melalui oksigen (O*) atau karbon (C*), dan konfigurasi adsorpsi yang berbeda menyebabkan perbedaan dalam selektivitas produk. [ 5 , 63 , 64 ] Sebuah studi DFT oleh Hellman dan rekan kerja [ 65 ] telah menunjukkan bahwa Pt, Pd, dan Au lebih menyukai karbon, sedangkan Cu, Ag, dan Ni lebih menyukai oksigen, sesuai dengan temuan oleh Meng et al. [ 66 ]
Katalis berbasis Pt dan Au sangat aktif. Katalis ini memiliki pusat pita-d yang rendah (2,25 eV) dan kecenderungan kuat untuk memfasilitasi deprotonasi. Pada Pt, elektrooksidasi gliserol biasanya dimulai dengan adsorpsi cepat baik melalui atom oksigen hidroksil, diikuti oleh deprotonasi gugus hidroksil primer atau sekunder untuk membentuk spesies alkoksida, atau melalui atom karbon pusat atau terminal, yang mengarah pada pembentukan berbagai zat antara yang terikat permukaan. Spesies zat antara ini kemudian dioksidasi menjadi produk seperti gliseraldehida dan dihidroksiaseton. Meskipun, Au menunjukkan aktivitas terbatas dalam lingkungan asam, ia menunjukkan kinerja katalitik yang tinggi dalam kondisi basa, [ 34 ] bersama dengan ketahanan yang lebih besar terhadap keracunan CO dan pembentukan oksida permukaan. [ 68 ] Pada Au, elektrooksidasi gliserol dimulai dengan deprotonasi gugus alkohol melalui ion hidroksida dalam elektrolit untuk membentuk alkoksida, diikuti oleh langkah deprotonasi kedua pada permukaan Au. [ 67 ] Deprotonasi pertama umumnya merupakan langkah penentu laju untuk sebagian besar alkohol dan diatur oleh pKa alkohol. Akibatnya, gliserol menunjukkan aktivitas tinggi pada katalis berbasis Au dalam kondisi basa. Koper et al. [ 34 ] menyelidiki mekanisme reaksi pada Pt polikristalin dan Au pada berbagai kondisi pH. Mereka mengusulkan bahwa dalam media basa, asam gliserat—yang terbentuk melalui gliseraldehida—adalah produk utama pada elektroda Pt. Demikian pula, pada elektroda Au, asam gliserat terbentuk dengan cepat melalui gliseraldehida dan selanjutnya dioksidasi menjadi asam glikolat dan asam format pada potensial yang lebih tinggi. Saat pH menurun, laju oksidasi gliserol turun secara signifikan pada Au dan Pt. Dalam kondisi netral, gliseraldehida menjadi produk dominan pada Pt dan Au, dan dalam lingkungan asam, hanya elektroda platinum yang menunjukkan aktivitas elektro-katalitik untuk oksidasi gliserol, sementara Au kehilangan aktivitasnya sepenuhnya. Lebih jauh, Garcia et al. [ 69 ] dan Fernandez et al. [ 52 , 55 , 70 ] menunjukkan bahwa susunan atom dan cacat permukaan logam menentukan mode pengikatan zat antara dan jalur reaksi selanjutnya, yang pada gilirannya mempengaruhi aktivitas dan selektivitas produk.
Kecenderungan katalis untuk mengikat molekul gliserol melalui oksigen atau karbon bergantung pada kondisi operasi (misalnya, pH, suhu, konsentrasi elektrolit, dan potensial yang diterapkan), dan menentukan selektivitasnya serta distribusi produk akhir. Namun, menyelidiki mekanisme reaksi secara eksperimental tetap menjadi tantangan. Akibatnya, perhitungan teori fungsi kerapatan (DFT) umumnya digunakan untuk mengkorelasikan produk yang diamati dari analisis HPLC dengan jalur reaksi yang mendasarinya. Hal ini menyebabkan beragam interpretasi mekanisme reaksi di berbagai penelitian.
Efek pH dan ketersediaan OH : pH menentukan bagaimana gliserol berinteraksi dengan katalis dan elektrolit, sehingga memengaruhi laju reaksi. Pertama-tama, aktivitas oksidasi gliserol umumnya lebih tinggi dalam kondisi basa karena keasamannya yang lemah (pKa = 14,15). [ 37 , 71 ] Korelasi tipe Hammett antara nilai pKa alkohol dan aktivitas oksidasinya menunjukkan bahwa pH di dekat pKa gliserol mendorong deprotonasi lebih cepat untuk membentuk gliseroksida, yang merupakan spesies yang lebih reaktif terhadap oksidasi. [ 11 , 71 ] Selain itu, jalur adsorpsi dan deprotonasi gliserol sangat bergantung pada ketersediaan OH⁻ dalam elektrolit. OH⁻ teradsorpsi ke permukaan katalis untuk membentuk gugus hidroksil terikat permukaan (*OH, di mana * menunjukkan situs aktif), menurunkan penghalang aktivasi dan memfasilitasi disosiasi ikatan O─H dan C-─H. [ 72 ] Pembentukan *OH pada permukaan katalis dapat terjadi pada overpotensial rendah melalui adsorpsi OH − yang terdapat dalam elektrolit alkali atau pada overpotensial tinggi melalui deprotonasi air yang teradsorpsi ketika ketersediaan OH − terbatas dalam elektrolit asam, [ 5 ] yang selanjutnya mengendalikan aktivitas dan selektivitas elektrooksidasi gliserol.
Kwon et al. [ 67 ] melaporkan bahwa, dalam kondisi basa kuat, gliserol diadsorpsi melalui atom oksigen dan mengalami deprotonasi yang dikatalisis basa homogen dari gugus hidroksi primer atau sekunder (pemisahan O─H) untuk menghasilkan gliseroksida. Spesies gliseroksida kemudian dapat dioksidasi melalui deprotonasi kedua (pemisahan C─H) pada atom karbon, membentuk DHA atau GALD. Oleh karena itu, konsentrasi spesies gliseroksida reaktif dalam antarmuka logam/larutan meningkat dengan konsentrasi OH − , yang mendorong reaksi oksidasi gliserol, seperti yang diamati dengan peningkatan kerapatan arus. Sebaliknya, jika tidak ada OH⁻ (atau pada pH rendah), laju reaksi menurun, yang menyebabkan kerapatan arus lebih rendah. [ 32 , 50 ]
Bergantung pada ketersediaan gugus *OH pada permukaan logam, zat antara yang diserap secara kimia dapat melanjutkan deprotonasi lebih lanjut dengan bereaksi dengan *OH atau menjalani pemutusan ikatan C─C untuk menghasilkan produk C2 atau C1 dan spesies peracun permukaan *CO jika tidak ada *OH yang cukup. *OH yang terbentuk pada permukaan Pt pada 0,5–0,6 V RHE [ 73 ] dapat mengoksidasi GALD yang diserap secara kimia menjadi asam gliserat dalam asam atau gliserat dalam basa. [ 74 ] Spesies peracun terbentuk ketika atom karbon terminal diserap dan deprotonasi lebih lanjut ditekan. [ 5 ] Peracunan permukaan akan memperlambat kinetika oksidasi gliserol jika tidak ada *OH yang tersedia secara luas, atau dapat bereaksi dengan *OH untuk menghasilkan karbonat dalam kondisi basa, di mana OH − tersedia dalam larutan. Oleh karena itu, reaksi dalam media basa lebih mudah daripada dalam kondisi asam karena pKa gliserol, dan ketersediaan *OH permukaan yang mendeprotonasi gliserol menjadi gliseroksida dan memakan spesies racun di permukaan.
Strategi untuk menyetel selektivitas terhadap DHA dan asam laktat : Asam laktat dianggap sebagai salah satu produk oksidasi gliserol yang paling menarik, seperti yang ditunjukkan pada Gambar 2 , karena ukuran pasarnya yang signifikan dan tingkat pertumbuhan yang diproyeksikan tinggi. Dihidroksiaseton adalah prekursor penting untuk menghasilkan asam laktat; oleh karena itu, produksi asam laktat dapat ditingkatkan dengan meningkatkan konversi selektif gliserol menjadi dihidroksiaseton. Konversi selektif ini telah dibuktikan layak dilakukan melalui modifikasi katalis berbasis Pt atau Pd dengan elemen blok-p seperti Bi dan Sb. Penggabungan adatom blok-p telah terbukti meningkatkan aktivitas dan stabilitas katalitik. [ 75 ] Secara khusus, modifikasi bismut pada Pt mencegah keracunan dan penonaktifan katalis, sementara pembentukan situs Pt–Bi meningkatkan selektivitas tinggi untuk DHA dalam media asam. [ 9 , 51 , 52 , 76 ]
Bahasa Indonesia: Untuk akhirnya menghasilkan asam laktat, piruvaldehida berfungsi sebagai perantara penting. Konversi DHA menjadi piruvaldehida telah diusulkan terjadi pada sistem katalis seperti Au/CeO₂-x, Pt/C-γ-Al₂O₃, dan Pt/C-Zeolit, di mana logam aktif didukung pada dukungan oksida logam asam. Transformasi piruvaldehida berikutnya menjadi asam laktat kemudian berlangsung secara spontan dalam kondisi basa, bahkan tanpa adanya katalis. Studi oleh Shi dan rekan kerja [ 50 ] mengungkapkan bahwa dukungan ceria asam Lewis memfasilitasi peningkatan transportasi massa dan meningkatkan cakupan OH pada permukaan anoda, sehingga meningkatkan proses Faradaic dan non-Faradaic untuk produksi asam laktat. Efek keasaman dukungan oksida logam pada hasil asam laktat untuk oksidasi gliserol baru-baru ini dilaporkan untuk sistem katalis tandem berbasis Pt oleh Luo et al. [ 12 , 15 ] Dengan membandingkan oksida logam dengan berbagai tingkat keasaman permukaan dengan kalkulasi DFT, penelitian ini menunjukkan bahwa kepadatan situs permukaan asam yang tinggi mendorong konversi dihidroksiaseton menjadi asam laktat melalui penataan ulang Cannizzaro dan reaksi kimia yang dikatalisis basa, mengikuti jalur hijau pada Gambar 4 .
Paduan Pt dan Au telah menarik lebih banyak perhatian dibandingkan dengan Pt dan Au monometalik. Situs Au dalam paduan Pt-Au memfasilitasi penyerapan spesies oksigen reaktif (biasanya *OH) pada permukaan katalis pada potensial rendah (<1,2 V RHE ), yang mempercepat dehidrogenasi gliserol. Selain itu, ia meningkatkan stabilitas dengan menekan keracunan katalis dan pembentukan oksida permukaan, sambil mempertahankan aktivitas tinggi pada potensial rendah seperti yang ditunjukkan oleh Pt monometalik. Paduan Pt–Au juga memodulasi mode pengikatan gliserol untuk mencegah pembelahan ikatan C─C, yang mengarah ke selektivitas tinggi untuk produk C₃, khususnya asam laktat dan dihidroksiaseton, seperti yang diilustrasikan oleh Gambar 3b .
Tantangan dalam memahami mekanisme reaksi : Memahami mekanisme reaksi untuk elektrooksidasi gliserol khususnya sulit karena beragamnya produk reaksi, berbagai konfigurasi pengikatan gliserol pada situs aktif, keberadaan jalur Faradaik dan non-Faradaik, dan kesulitan dalam mendeteksi zat antara yang tidak stabil. Tantangan dalam deteksi produk dan keterbatasan teknik analisis produk dibahas di Bagian 3.3 .
Ketidakstabilan GALD dalam kondisi basa berkontribusi pada koeksistensi jalur Faradaik dan non-Faradaik. Dengan adanya OH⁻, GALD terurai menjadi berbagai produk, bahkan tanpa katalis. [ 34 ] GALD dapat diubah menjadi asam gliserat melalui proses Faradaik yang melibatkan transfer proton dan elektron atau dapat berubah menjadi berbagai senyawa melalui proses non-Faradaik, untuk membentuk asam gliserat, atau senyawa seperti sorbitol atau fruktosa melalui dimerisasi. [ 77 ] Ia juga dapat mengalami kondensasi aldol untuk menghasilkan DHA. [ 32 ] Baik DHA maupun GALD selanjutnya terdegradasi menjadi gliserat, glikolat, format, dan laktat dalam lingkungan basa. Akibatnya, konversi zat antara non-Faradaik dapat menyebabkan kesalahan interpretasi hasil oleh peneliti, karena keberadaan karboksilat tidak secara eksklusif menunjukkan jalur reaksi Faradaik.
3 Metode dan Protokol Benchmark untuk Pengukuran Elektrokimia
3.1 Berbagai Pengaturan untuk Pengujian Elektrokimia
Konfigurasi tiga elektroda : Elektroda cakram berputar (RDE) umumnya digunakan [ 78 ] untuk pembandingan katalis mutakhir dan melakukan penyaringan aktivitas elektrokatalitik cepat dengan jumlah katalis minimal. Permukaan RDE yang halus dan datar membuatnya ideal untuk studi kinetik dengan efek minimal dari ketebalan dan kekasaran permukaan. Katalis dilapisi ke permukaan datar konduktif, seperti elektroda karbon kaca, sebagai pengumpul arus. [ 79 ] RDE dapat dipasangkan dengan beberapa teknik spektroskopi dan kromatografi untuk analisis kualitatif dan kuantitatif mekanisme reaksi, zat antara, dan produk. [ 34 , 69 , 80 ] Misalnya, Kwon et al. [ 81 ] menggabungkan studi voltametri siklik (CV) pada cakram emas dan platinum polikristalin dengan pengambilan sampel produk daring cepat untuk mengkorelasikan konsentrasi produk dengan profil arus. [ 82 ] Penggunaan kromatografi cair kinerja tinggi (HPLC) untuk analisis kuantitatif produk yang dihasilkan selama pengukuran RDE terbatas karena jumlah produk yang rendah. Akibatnya, RDE telah digunakan dalam studi FTIR in situ, di mana RDE yang diendapkan oleh katalis ditekan ke jendela transparan IR dalam sel tiga elektroda khusus untuk membuat film elektrolit tipis, untuk memeriksa permukaan secara kualitatif untuk zat antara reaksi dan/atau produk. [ 37 , 83 – 85 ] Pengukuran pada RDE sangat sensitif terhadap faktor-faktor seperti ketebalan katalis, kekasaran permukaan elektroda, pilihan elektroda referensi dan lawan, teknik pengecoran tinta, dan pengukuran aktivitasnya cenderung dipengaruhi oleh kontaminan dari elektrolit, gelas dan gas.
Bahasa Indonesia: Selain RDE karbon kaca, katalis dapat diendapkan secara fisik atau kimia ke substrat konduktif listrik lainnya seperti busa nikel atau kain karbon, untuk berfungsi sebagai elektroda kerja yang berdiri sendiri dalam pengaturan tiga elektroda, biasanya dalam sel kompartemen tunggal bebas membran. Pengaturan ini memungkinkan pemuatan katalis yang lebih tinggi dan area substrat yang lebih besar daripada RDE, dengan demikian, kerapatan arus yang lebih tinggi dapat dicapai, yang memungkinkan tidak hanya untuk evaluasi aktivitas, tetapi juga stabilitas dan analisis produk. [ 14 , 86 ] Namun, substrat ini sering kali memiliki area aktif geometris dan elektrokimia yang tidak terdefinisi dengan baik, sehingga sulit untuk menentukan aktivitas spesifik massa dari bahan katalis. Keterbatasan sel kompartemen tunggal adalah bahwa produk yang terbentuk pada elektroda kerja dapat berkurang pada elektroda lawan, yang menyebabkan hasil yang tidak akurat. Untuk mengatasi hal ini, sel tipe H, seperti yang dilaporkan oleh Dai et al., [ 41 ] dengan dua kompartemen yang dipisahkan oleh membran pertukaran ion, lebih disukai. Pengaturan ini mengisolasi elektroda lawan untuk mencegah reaksi balik produk, dan ini menghindari pencucian ion Cl − dari elektroda referensi yang mengandung Cl atau logam terlarut dari elektroda lawan yang dapat mengganggu pengukuran. [ 87 ]
Konfigurasi dua elektroda : Sebagian besar studi untuk elektrooksidasi gliserol berfokus pada pengembangan katalis tahap awal dan jarang melakukan ekstrapolasi ke skala sel penuh dalam sistem MEA. Pengukuran MEA memberikan gambaran yang lebih representatif tentang kinerja perangkat nyata seperti sel bahan bakar atau elektroliser. Hal ini memungkinkan evaluasi elektrolisis gliserol dibandingkan dengan elektrolisis air, kuantifikasi hidrogen dan produk reaksi, dan wawasan tentang konsumsi energi listrik. Tuleushova dkk. [ 30 ] meninjau perkembangan terkini dalam sistem elektrolisis MEA untuk elektrooksidasi gliserol dan reduksi air dalam elektrolit asam dan basa. Dalam media asam, proton yang dihasilkan di anoda perlu bermigrasi ke katoda untuk direduksi menjadi H2 dan karenanya, diperlukan membran permeabel kation. Sebaliknya, dalam media basa, membran permeabel anion diperlukan untuk memungkinkan ion hidroksil yang dihasilkan di katoda bermigrasi ke anoda untuk mendukung oksidasi gliserol. [ 67 , 88 ]
Katalis aktif dapat dilaminasi atau disemprotkan/diteteskan langsung ke membran, atau ke substrat elektro-konduktif seperti kertas karbon atau busa nikel, [ 89 ] yang diapit di antara dua medan aliran. Kertas karbon hidrofilik atau substrat jenis busa yang mendukung transportasi cairan biasanya digunakan, mengingat elektrooksidasi gliserol terjadi dalam fase berair. Sebuah karya terbaru oleh Dai et al. [ 41 ] menyajikan sistem asam-alkali berbasis AEM baru untuk menekan persilangan produk cair, meningkatkan kerapatan arus dan mengurangi potensi timbulnya elektrooksidasi gliserol dan mengurangi pembelahan ikatan C─C yang tidak diinginkan dan mengurangi tegangan sel. Selain pengaturan MEA, Yan et al. [ 11 ] menggunakan sel aliran tanpa membran bertumpuk tiga unit untuk elektrooksidasi gliserol dan etilen glikol dari area kerja yang besar dan mampu mencapai arus yang relevan secara industri.
Meskipun MEA dapat memberikan wawasan ke dalam kinerja perangkat nyata, MEA tidak cocok untuk evaluasi aktivitas karena perbedaan potensial sel yang diukur antara anoda dan katoda adalah jumlah tegangan di semua komponen sel tetapi tidak memungkinkan untuk penentuan potensial pada elektroda individual. [ 90 , 91 ] Integrasi elektroda referensi telah disajikan untuk elektrolisis air di elektroliser [ 92 , 93 ] dan reduksi CO 2 di sel aliran, [ 94 ] tetapi belum secara khusus diterapkan untuk elektrooksidasi gliserol.
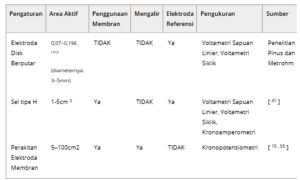
Lebih jauh lagi, transferabilitas hasil RDE ke lingkungan MEA dibatasi oleh perbedaan mendasar dalam jalur transportasi massa. Penggunaan MEA memerlukan pengoptimalan dan sering kali memerlukan jumlah material yang lebih besar, sehingga sulit untuk mempelajari kinerja intrinsik katalis. Teknik penjembatan seperti sel tipe-H menawarkan representasi kondisi mirip MEA yang lebih baik sambil mempertahankan kesederhanaan RDE. Meskipun demikian, kesesuaian pengaturan untuk pengukuran aktivitas oksidasi gliserol belum dibahas secara kritis, karena sebagian besar penelitian berfokus pada pengembangan katalis daripada metode standar untuk evaluasi aktivitas katalis. Tabel 3 merangkum skala tipikal area aktif dan kondisi operasi yang digunakan untuk RDE, sel-H, dan MEA. Nilai-nilai ini dirata-ratakan berdasarkan konfigurasi yang umum digunakan yang dilaporkan di berbagai kelompok penelitian dan publikasi. Ukuran RDE terutama ditentukan oleh dimensi cakram yang tersedia secara komersial yang disediakan oleh produsen seperti Pine Research dan Metrohm. Skala sel-H dan MEA dipengaruhi oleh volume sel internal atau dimensi saluran aliran, yang juga bervariasi tergantung pada desain spesifik yang diadopsi oleh berbagai laboratorium. Pembahasan tentang penggunaan umum RDE, sel H, dan MEA dalam literatur disediakan di Bagian 3.1 .
Tabel 3. Ringkasan rincian untuk berbagai pengaturan yang digunakan untuk pengukuran Elektrokimia.
3.2 Metode dan Protokol Benchmark untuk Pengukuran Elektrokimia
Aktivitas elektrokatalis untuk elektrooksidasi gliserol : CV dan voltametri sapuan linier (LSV) adalah metode yang paling banyak digunakan untuk mengevaluasi aktivitas katalitik dalam rentang potensial, biasanya dengan mengevaluasi kerapatan arus pada potensial tertentu atau potensial pada kerapatan arus tertentu, dengan adanya gliserol dalam elektrolit. Pt/C komersial, katalis acuan untuk HER/HOR dan ORR, juga berlaku untuk elektrooksidasi gliserol untuk mempelajari efek berbagai parameter eksperimen, [ 90 , 95 ] dan menjadi fokus bagian ini. Prosedur yang direkomendasikan untuk persiapan elektroda, pembersihan permukaan katalis dan pengukuran CV menggunakan Pt/C telah ditetapkan untuk OER. [ 91 , 96 ]
Pengukuran aktivitas yang andal memerlukan pertimbangan cermat faktor-faktor seperti stabilitas katalis, rentang pindai, suhu, dan pH. [ 97 ] Rentang pindai harus dikontrol untuk mencegah perubahan struktural atau degradasi katalis. Misalnya, bahan berbasis Pt aktif untuk elektro-oksidasi gliserol dari 0,5 V RHE tetapi teroksidasi pada potensial di atas 0,95 V RHE . [ 98 ] Oleh karena itu, rentang pindai perlu dibatasi untuk menghindari pelarutan Pt [ 99 ] dan perubahan struktural yang dapat menyebabkan variasi dalam aktivitas. Untuk elektro-oksidasi alkohol pada Pt, rentang potensial biasanya dibatasi di bawah 1 V RHE . [ 35 , 69 ] Suhu juga memainkan peran penting dalam elektro-oksidasi gliserol di mana suhu yang lebih tinggi meningkatkan konduktivitas elektrolit, mengurangi resistansi keseluruhan, [ 100 ] dan menurunkan energi aktivasi yang diperlukan untuk oksidasi gliserol elektrokimia, yang mengarah ke aktivitas reaksi yang lebih tinggi. [ 101 ] Lebih jauh lagi, elektro-oksidasi gliserol sensitif terhadap pH. Katalis berbasis logam mulia, seperti Pt dan Au, menunjukkan kerapatan arus yang lebih tinggi dalam kondisi basa (dengan konsentrasi gliserol dan potensial elektroda yang sama), sedangkan kondisi asam secara signifikan mengurangi aktivitas oksidasi gliserol pada katalis ini. [ 34 ] Untuk membandingkan aktivitas spesifik dan massa yang diperoleh oleh CV dan LSV pada kondisi eksperimen yang berbeda, koreksi untuk kerugian Ohmik dan arus kapasitif latar belakang, serta normalisasi arus berdasarkan luas permukaan atau oleh pemuatan massa katalis adalah penting.
Pembandingan terhadap katalis yang dipelajari secara luas dengan prosedur yang mapan untuk pengukuran elektrokimia sangat penting untuk memastikan keterbandingan karakteristik elektrokimia di seluruh studi. Ini khususnya penting untuk sistem katalis logam kompleks, di mana aktivitasnya harus dibandingkan dengan aktivitas katalis monometalik yang sesuai, pada katalis komersial standar, misalnya dengan membandingkan respons profil saat ini terhadap siklus potensial dengan dan tanpa gliserol. Misalnya, studi tentang katalis berbasis Pt, seperti Pt yang dimodifikasi Bi, [ 9 , 43 , 51 , 45 ] paduan Pt-Au, [ 41 , 49 ] dan Pt/C-Al 2 O 3 , [ 12 ] dibandingkan dengan aktivitas Pt monometalik. Demikian pula, penelitian terhadap katalis berbasis Au, termasuk Au/CoOOH, [ 86 ] Au-Ag [ 9 ] dan paduan Au-Cu, [ 55 ] dan Au/CeO 2-x [ 50 ] harus dibandingkan dengan Au murni.
Stabilitas elektrokatalis untuk elektrooksidasi gliserol : Stabilitas katalis dapat dievaluasi menggunakan uji tegangan terakselerasi (AST) yang menerapkan kronoamperometri (CA) dan kronopotensiometri (CP), yang mengukur respons arus terhadap potensial konstan yang diterapkan atau respons potensial terhadap arus konstan dari waktu ke waktu. Kedua metode tersebut diikuti dengan analisis komposisi elektrolit yang dihasilkan menggunakan teknik kromatografi untuk menentukan konversi gliserol, selektivitas produk, hasil, dan efisiensi Faradaic.
CA sebaiknya dilakukan dalam sel tiga elektroda dengan elektroda referensi untuk mengendalikan potensial yang diterapkan pada elektroda kerja. Keandalan pengukuran CA dapat diverifikasi dengan membandingkan data CV yang dikoreksi ohmik (iR) dan latar belakang dan CA yang dikompensasi iR, di mana respons arus pada potensial tertentu harus saling sesuai. Dalam eksperimen CA yang diperpanjang (biasanya 1–30 jam), kerapatan arus berkurang karena konsumsi elektrolit dan penonaktifan katalis yang disebabkan oleh perantara reaksi atau akumulasi produk. Untuk mengatasi hal ini, pengukuran CA siklik [ 55 ] atau intermiten [ 86 , 102 ] disarankan, dengan mengisi ulang elektrolit dan mengganti potensial hidup/mati, untuk mempertahankan kerapatan arus tinggi awal, yang biasanya meluruh dalam waktu 2 jam selama metode CA konvensional. Selain itu, pengukuran CA intermiten dapat membantu membedakan antara penonaktifan karena keracunan dan degradasi katalis. CP umumnya dilakukan dalam konfigurasi MEA dengan menerapkan arus konstan dan memantau perubahan tegangan sel. Elektrolisis dihentikan ketika tegangan sel meningkat ke nilai-nilai di mana OER menjadi mungkin secara termodinamika; lebih lagi, jika elektroda mengandung karbon, potensial di atas 1,2 V RHE dihindari untuk meminimalkan korosi karbon. [ 103 , 104 ] CP merepresentasikan kondisi reaksi yang lebih dekat dengan perangkat nyata dan menyediakan informasi yang relevan secara industri seperti kuantifikasi produk, konversi gliserol, dan konsumsi energi untuk elektrolisis jangka panjang, mulai dari hingga 30 jam pada skala lab hingga beberapa bulan pada skala industri, saat beroperasi pada kerapatan arus konstan. Perlu dicatat bahwa CA jarang dilakukan dalam pengaturan MEA; untuk mencapai ini, elektroda referensi harus dimasukkan ke dalam MEA agar dapat mengendalikan potensial dengan baik di anoda.
Studi telah menyoroti perbedaan antara uji stabilitas dalam pengaturan RDE dan konfigurasi MEA untuk katalis OER. [ 105 – 107 ] Waktu hidup katalis yang diukur dalam pengaturan RDE kira-kira tiga hingga empat orde besaran lebih rendah daripada yang diukur dalam MEA. [ 82 ] Penyebab perbedaan ini masih kurang dipahami dan belum diselidiki secara sistematis untuk elektrooksidasi gliserol. Penelitian di masa mendatang harus difokuskan pada identifikasi asal perbedaan ini dan penilaian relevansinya dengan sistem elektrooksidasi gliserol.
Efek kontaminan : Kontaminan dapat masuk melalui pasokan elektrolit atau gas, atau dapat berasal dari degradasi katalis, elektroda referensi atau elektroda lawan, dan komponen sel lainnya, yang dapat memengaruhi pengukuran aktivitas. Oleh karena itu, perlu diperhatikan untuk memastikan kondisi yang benar-benar bersih selama pengujian elektrokimia dengan menggunakan bahan sel yang tepat, yaitu kaca dalam keadaan asam dan PTFE dalam keadaan basa untuk menghindari goresan pada peralatan gelas, bahan kimia dengan kemurnian tinggi untuk persiapan elektrolit, yaitu bahan kimia kelas Merck Suprapur seperti yang disarankan oleh Wei et al., [ 91 ] dan membersihkan sel sebelum setiap pengukuran menggunakan protokol yang direkomendasikan untuk membersihkan peralatan gelas dan polimer. [ 91 , 96 ] Peralatan gelas dibersihkan terlebih dahulu dalam piranha (98% H 2 SO 4 (Merck, Emsure) dan 30% H 2 O 2 (Merck, Emsure), 3:1 v/v) selama minimal 24 jam, lalu dibersihkan beberapa kali dalam air Millipore 18,2 MΩ cm pada suhu 85–90 °C untuk menghilangkan kemungkinan jejak larutan pembersih. Untuk memverifikasi kebersihan dan prapengondisian sel, pengukuran latar belakang dalam elektrolit pendukung harus dilakukan dengan membandingkannya dengan bahan mutakhir seperti Pt RDE polikristalin atau nanopartikel Pt yang dilapisi pada karbon kaca RDE, mengikuti protokol yang ditetapkan dan membandingkannya dengan data literatur. [ 91 , 108 , 109 ] Pemindaian latar belakang membantu mengonfirmasi bahwa tidak ada spesies elektroaktif yang ada dalam elektrolit dan semua komponen sel dalam kondisi baik. Gambar 6 menggambarkan CV yang wajar untuk Pt RDE polikristalin dan nanopartikel Pt pada RDE karbon kaca dalam asam dan basa.
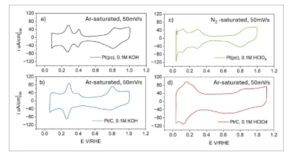
Gambar 6
Buka di penampil gambar
Presentasi PowerPoint
Voltametri siklik (CV) dari cakram Pt polikristalin dan nanopartikel Pt pada cakram karbon kaca dalam keadaan basa (a,c) dan dalam keadaan asam (b,d). Semua pengukuran diperoleh pada 50 mV s −1 dalam N 2 – atau 0,1 M HClO 4 jenuh Ar atau 0,1 M KOH pada suhu kamar. Data yang disajikan diplot ulang dari data yang dilaporkan dalam ref. [ 109 ] untuk a dan b, dalam ref. [ 110 ] untuk c, dan dalam ref. [ 111 ] untuk d, masing-masing. Kepadatan arus pada sumbu y dari a, b, dan d dirujuk ke luas permukaan Pt aktual, kepadatan arus pada sumbu y di c dirujuk ke luas cakram.
Profil CV diplot ulang dari data yang dilaporkan dalam literatur, [ 109 – 111 ] di mana cakram platinum polikristalin dan nanopartikel platinum digunakan sebagai elektroda kerja. Perilaku elektrokimia diselidiki melalui CV dalam media alkali dan asam jenuh Ar atau N₂, khususnya, 0,1 M KOH dan 0,1 M HClO₄, pada laju pindai 50 mV/s. Adsorpsi dan desorpsi proton terjadi di daerah pengendapan underpotensial Pt–H, berkisar dari 0,08 hingga 0,5 V RHE dan lebih jelas dalam kondisi alkali daripada dalam kondisi asam. Adsorpsi dan desorpsi OH⁻ terjadi di atas 0,6 V RHE , yang sesuai dengan oksidasi permukaan platinum dan reduksi oksida platinum berikutnya.
Untuk elektroliser dua elektroda, khususnya sistem rakitan elektroda membran, tempat elektrooksidasi gliserol terjadi di sisi anoda, beberapa produk atau zat antara (seperti CO) dan CO2 terlarut ( karbonat) di udara di kompartemen katoda dan anoda dapat diadsorpsi dengan kuat pada permukaan katalis. Adsorpsi CO dan karbonat yang kuat ini dapat meracuni katalis, khususnya platinum, dan menghambat adsorpsi dan deprotonasi molekul gliserol, sehingga secara signifikan mengurangi aktivitas katalitik. Oleh karena itu, untuk mengurangi efek buruk polutan gas, seperti CO dan karbonat, pada kinerja katalitik reaksi anoda, direkomendasikan agar sistem dibersihkan dengan gas inert seperti N2 atau Ar. Lebih jauh, penyediaan oksigen selama oksidasi gliserol menjadi DHA dan GALD diyakini dapat meningkatkan produksi produk C3, daripada memutus tulang punggung karbon, [ 112 ] dan dapat meningkatkan laju reaksi keseluruhan.
Pemilihan elektroda referensi dan elektroda lawan : Pemilihan elektroda referensi dan elektroda lawan belum dilaporkan secara sistematis khususnya untuk elektrooksidasi gliserol, oleh karena itu, kriteria untuk memilih elektroda yang sesuai didasarkan pada praktik yang direkomendasikan untuk pemisahan air dan sel bahan bakar. Potensi elektroda referensi yang stabil dan terdefinisi dengan baik memastikan pengukuran dan kontrol yang akurat terhadap potensi yang diterapkan pada katalis. Wei et al. [ 91 ] merasionalisasi pemilihan elektroda referensi dan menekankan perlunya pelaporan aktivitas pada skala elektroda hidrogen reversibel (RHE) dan merinci prosedur untuk mengubah potensi yang diukur menjadi RHE. [ 113 ] Praktik yang paling dapat diandalkan adalah menggunakan RHE yang tersedia secara komersial sebagai elektroda referensi. Sebagai alternatif, semua potensi yang diukur oleh elektroda referensi lain harus dikalibrasi ke skala RHE dengan mengikuti protokol operasi standar. [ 114 ] Selain itu, untuk menggunakan elektroda referensi yang mengandung Cl − secara wajar , seperti elektroda kalomel jenuh (SCE) dan elektroda referensi perak klorida (Ag/AgCl), di mana ion Cl − dapat mengganggu pengukuran aktivitas, pengguna disarankan untuk mempertimbangkan konsentrasi larutan KCl, pelindian Cl−, dan gangguan dari elektrolit alkali. Dalam elektrolit alkali, elektroda referensi Hg/HgO merupakan pilihan yang lebih disukai. [ 87 ]
Elektroda lawan yang wajar harus dipilih dengan hati-hati untuk memastikan bahwa elektroda tersebut dapat memasok atau menyalurkan elektron untuk reaksi pada elektroda kerja, dan elektroda tersebut tidak mempengaruhi pengukuran aktivitas. [ 91 ] Kawat, foil, atau jaring Pt adalah elektroda lawan yang kuat yang telah digunakan secara luas untuk oksidasi gliserol elektrokimia. Namun, Pt dapat larut dalam pH asam dan basa selama oksidasi Pt dan reduksi oksida Pt berikutnya. [ 115 ] Pt yang terlarut dalam elektrolit cenderung mengendap secara elektrode pada elektroda kerja dan mempengaruhi respons elektrokimia, terutama pada katalis bebas PGM. [ 87 ] Meskipun demikian, sejumlah penelitian tentang elektrooksidasi biomassa pada katalis non-PGM masih menggunakan elektroda lawan Pt untuk pengukuran elektrokimianya. [ 58 , 86 ] Lazaridis dkk. [ 88 ] mengusulkan bahwa potensial dalam pengaturan MEA dapat ditentukan dengan andal pada skala RHE, di mana sisi hidrogen berfungsi sebagai elektroda referensi dan elektroda lawan, asalkan sisi hidrogen tidak terlalu beracun. Namun, selama elektrolisis gliserol, sisi hidrogen dapat dengan mudah diracuni oleh spesies yang berpindah dari sisi anoda. Lebih jauh, untuk memperkirakan sisi H 2 sebagai lawan dan referensi seperti RHE memerlukan pasokan H 2 yang berlebihan pada sisi katoda, yang pada gilirannya memerlukan muatan Pt yang tinggi untuk memfasilitasi reaksi katoda (biasanya HER). Hal ini menyoroti perlunya penentuan potensial dan aktivitas yang cermat saat menggunakan MEA, dan penggabungan elektroda referensi ke dalam MEA dapat bermanfaat.
Kompensasi iR : Kompensasi iR umumnya diterapkan dalam menganalisis data elektrokimia untuk pengukuran aktivitas dalam sistem tiga elektroda untuk memperhitungkan penurunan potensial ohmik (yaitu, penurunan iR) yang disebabkan oleh aliran arus ionik dalam larutan elektrolit yang menjembatani elektroda kerja dan referensi. [ 116 , 117 ] Aspek-aspek seperti metode koreksi dan faktor koreksi harus dipertimbangkan ketika menerapkan kompensasi iR. Pertama, kompensasi iR dapat dilakukan baik pascapengukuran secara manual menggunakan resistansi yang telah ditentukan (diasumsikan konstan) untuk mengoreksi data, atau online secara otomatis melalui instrumen dengan kompensasi iR internal yang menyesuaikan potensial yang diterapkan untuk mengatasi penurunan iR. Namun, metode online sering menyebabkan gangguan pada pengukuran. [ 118 ] Selain itu, faktor sering diterapkan pada resistansi terukur sebesar 85% dan 95% untuk kompensasi parsial untuk menghindari osilasi potensiostat dengan kompensasi online dan koreksi berlebih dengan koreksi pascapengukuran. Koreksi berlebih dapat menyebabkan pengurangan signifikan dalam kelebihan potensial katalis dan memengaruhi indikator pembandingan seperti kerapatan arus pada potensial terapan tertentu, yang mengakibatkan ekstrapolasi aktivitas katalitik yang salah. Koreksi berlebih ini dapat lebih dramatis pada arus tinggi. Namun, pilihan persentase koreksi sebagian besar bersifat empiris, tidak memiliki dukungan teoritis, dan kurang terdokumentasi untuk elektrooksidasi gliserol. Misalnya, Terekhina et al. [ 119 ] menyajikan data elektrokimia mereka dengan kompensasi iR 85% untuk memperhitungkan resistansi yang tidak terkompensasi dalam kisaran 1,7–3,7 Ω untuk KOH 2 M dan elektrolit gliserol, sementara Duan et al. [ 116 ] mengoreksi LSV mereka untuk elektrooksidasi gliserol dengan faktor 60%.
Product cross-over : Untuk sistem yang dipisahkan oleh membran, terutama membran pertukaran anion (AEM), crossover produk cair yang penting telah diketahui muncul dari difusi yang didorong oleh gradien konsentrasi yang tak terelakkan melalui AEM. [ 120 ] Tantangan utama untuk sistem AEM ditemukan dalam ketahanan ionomer dan membran daripada stabilitas katalis. [ 88 ] Transfer anion dari anolit ke katolit didominasi oleh difusi karena elektromigrasi secara inheren mendorong transfer anion dari katoda ke anoda. Rasio crossover produk meningkat dari 28% pada 10 mA cm −2 menjadi 30% pada 25 mA cm −2 karena peningkatan gradien konsentrasi produk sepanjang AEM tetapi mulai menurun ketika arus mencapai di atas 200 mA cm −2 . [ 121 ] Deteksi dan kuantifikasi produk cair harus memperhitungkan crossover spesies produk dari sisi anoda ke sisi katoda melalui membran. Persilangan anion produk anoda ke katolit dalam elektroliser MEA sering kali diabaikan tetapi dapat memengaruhi HER di katode dan dapat meningkatkan biaya pemisahan dan pemurnian. Konsentrasi produk dalam anolit dan katolit harus dilaporkan secara standar, tidak hanya untuk mengukur total produksi tetapi juga untuk mengevaluasi tingkat keracunan HER.
3.3 Analisis Produk
Penting untuk memiliki metode yang akurat dan cepat untuk analisis, identifikasi, dan kuantifikasi semua produk oksidasi gliserol secara bersamaan. Spektrometri massa elektrokimia (MS) daring atau diferensial memberikan sensitivitas dan spesifisitas yang tinggi untuk deteksi tetapi terbatas pada spesies yang mudah menguap. [ 80 ] Untuk mendeteksi zat antara dan produk yang larut untuk mengurai jalur reaksi, kombinasi pengukuran elektrokimia (voltametri, galvanostatik, dan potensiostatik) dan teknik spektroskopi dan kromatografi telah diterapkan. [ 68 ]
3.3.1 Teknik Kromatografi
HPLC digunakan untuk mendeteksi dan mengukur kuantitas produk cair yang larut berdasarkan perubahan indeks bias atau absorbansi UV–vis. [ 122 ] Dalam kasus elektrooksidasi gliserol, mayoritas produk menunjukkan waktu retensi yang berbeda dalam kolom dan memiliki indeks bias karakteristik dari fase mobil, dan panjang gelombang absorbansi maksimum yang berbeda dari spektrum UV–vis. Pengecualian untuk ini adalah zat antara yang tidak stabil GALD dan DHA, yang terurai pada pH tinggi pada skala waktu yang jauh lebih pendek daripada pengukuran. [ 32 , 34 ] Oleh karena itu, sulit untuk mendeteksi spesies ini dalam kondisi basa tanpa gangguan produk yang terbentuk oleh dekomposisi mereka. Dengan demikian, zat antara oksidasi gliserol hanya dilaporkan dalam kondisi asam. [ 53 , 69 , 45 ] Selain itu, karbonat adalah jenis lain dari turunan gliserol yang tidak dapat diukur dengan HPLC. Potensi untuk deteksi dan kuantifikasinya dibahas dalam bagian teknik spektroskopi dan teknik lain untuk bagian deteksi dan kuantifikasi produk.
Deteksi indeks bias dibatasi oleh selektivitas dan sensitivitas senyawa yang dapat dideteksi yang buruk, sehingga dapat mengalami masalah tumpang tindih, yang memerlukan pemisahan kolom yang cukup untuk mengidentifikasi puncak-puncak individual. Selain itu, RID mudah terpengaruh oleh fluktuasi suhu dan tekanan. Detektor susunan dioda (DAD) atau detektor panjang gelombang variabel (VWD) adalah dua jenis detektor absorbansi yang menawarkan sensitivitas yang relatif tinggi dan respons yang hampir seragam. DAD menangkap data absorbansi di seluruh wilayah spektrum UV–vis (dalam rentang panjang gelombang 190–900 nm) yang menyediakan kromatogram multipanjang gelombang untuk setiap senyawa dalam satu kali pengujian, yang mungkin berguna dalam membedakan antara analit dengan spektrum absorbansi yang berbeda. Deteksi absorbansi digunakan jika absorbansi sebanding dengan konsentrasi komponen. Namun, konsentrasi yang terlalu tinggi dapat membahayakan keakuratan pengukuran menggunakan detektor UV. Hal ini dijelaskan oleh hukum Lambert–Beer, di mana hubungan linier antara respons UV dan konsentrasi analit dapat menyimpang hingga 10% pada konsentrasi tinggi. [ 123 ] Dengan demikian, kuantifikasi harus terjadi dalam rentang konsentrasi di mana absorbansi tetap berbanding lurus dengan konsentrasi. Kombinasi detektor RI dan UV–vis dapat membantu dalam menyelesaikan tumpang tindih antara gliserol dan DHA atau puncak asam format melalui data spektral. Misalnya, DHA dapat diidentifikasi secara selektif dengan deteksi UV pada 210 nm, sedangkan gliserol tidak memiliki absorbansi UV pada panjang gelombang ini. Oleh karena itu, metode deteksi RI dan absorbansi harus digunakan secara sinergis karena keduanya saling melengkapi. [ 11 , 14 , 124 ]
Kondisi metode dan resolusi pemisahan : Analisis simultan produk oksidasi gliserol menjadi rumit karena resolusi yang buruk dalam kromatogram. Parameter utama seperti suhu dan tekanan kolom, pH, volume injeksi, dan laju alir harus dioptimalkan. Beltran-Prieto et al. [ 124 ] meninjau kondisi analitis di seluruh metode HPLC yang dipublikasikan dan memvalidasi protokol untuk memisahkan turunan gliserol utama, yaitu gliseraldehida, dihidroksiaseton, mesoksalat, tartronik, dan asam glikolat dan gliserat. Tabel 4 menyusun pengaturan HPLC representatif dari literatur, termasuk jenis kolom, laju alir, volume injeksi, pilihan eluen, dan kondisi suhu. Meskipun fokus analitis bervariasi di seluruh studi, sebagian besar berhasil memisahkan produk oksidasi utama. Misalnya, Demirel et al. [ 125 ] dan Liebminger et al. [ 126 ] menggunakan kolom Aminex HPX-87H dengan indeks bias dan detektor UV untuk mengidentifikasi DHA, asam gliserat, asam tartronik, dan asam mesoksalat tanpa tumpang tindih puncak. Demikian pula, Zope et al. [ 127 ] menggunakan HPLC untuk menyelidiki oksidasi fase air aerobik gliserol di atas katalis Au dan Pt yang didukung dan produk yang ditargetkan meliputi asam gliserat, asam glikolat, asam oksalat, asam tartronik, dan asam asetat. Dalam sistem elektrokimia, Yan et al. [ 11 , 14 ] dan Huang et al. [ 50 ] menggunakan HPLC untuk identifikasi produk, sementara Kwon et al. [ 81 ] menggabungkan HPLC dengan ujung pengambilan sampel online dan CV untuk secara langsung mengkorelasikan konsentrasi produk dengan profil arus elektrokimia.
Tabel 4. Kondisi metode yang dilaporkan dalam literatur untuk identifikasi produk oksidasi gliserol dengan HPLC.
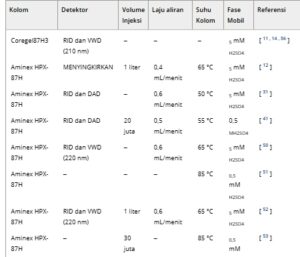
Kolom pertukaran kation, yang umum digunakan untuk pemisahan karbohidrat dan asam organik sederhana, digunakan untuk memisahkan karboksilat yang terbentuk melalui oksidasi gliserol dan dioperasikan pada suhu 30 hingga 60 °C. [ 14 , 69 ] Suhu kolom memengaruhi sifat fisik fase mobil dan fase sampel, yang selanjutnya memengaruhi indeks bias dan efisiensi pemisahan senyawa. Volume injeksi dan laju alir menentukan kuantitas dan kecepatan sampel dimasukkan ke dalam kolom dan detektor. Untuk mendeteksi senyawa encer dalam sampel, volume injeksi tinggi dikombinasikan dengan laju alir rendah direkomendasikan untuk meningkatkan penyerapan senyawa ke resin di dalam kolom guna meningkatkan pemisahan.
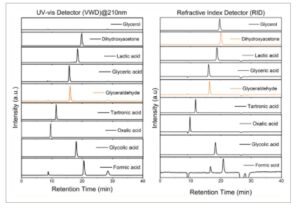
Gambar 7 mengilustrasikan waktu retensi senyawa yang diharapkan terdeteksi oleh VWD dan RID menggunakan kolom Aminex HPX-87H pada 40 °C dengan laju alir 0,4 mL/menit dan volume injeksi 10 uL. Kromatogram menunjukkan puncak yang tumpang tindih untuk DHA, gliserol GALD, dan asam gliserat. Puncak yang tumpang tindih dapat dipisahkan dengan menyesuaikan parameter seperti jenis detektor, suhu detektor, suhu kolom, laju alir, panjang gelombang UV–vis, dan fase mobil, dan seterusnya. Kwon dan Koper [ 81 ] menunjukkan bahwa puncak yang tumpang tindih dari GALD dan asam gliserat pada 30 °C dapat diatasi dengan meningkatkan suhu kolom hingga 80 °C, meningkatkan perbedaan waktu retensi dari 3,6 menjadi 55,8 detik. Namun, hal ini dibatasi oleh batasan suhu, seperti suhu maksimum 60 °C untuk Aminex HPX-87H. Selain itu, suhu kolom yang lebih tinggi mengurangi resolusi antara puncak GALD dan asam glikolat. Chen et al. [ 128 ] juga melaporkan masalah dengan pemisahan gliserol dan DHA menggunakan kolom pengecualian ion HPX-87H dengan H 2 SO 4 sebagai fase mobil dan mereka mengembangkan metode untuk memisahkan gliserol dan DHA dengan resolusi yang baik menggunakan fase mobil yang terdiri dari air deionisasi-asetonitril yang mengandung 0,5 mM H 2 SO 4 yang juga diterapkan oleh Liang et al. [ 129 ] Namun, resolusi metode ini terbatas pada lima produk gliserol dan data validasi terperinci tidak disediakan.
Gambar 7
Buka di penampil gambar
Presentasi PowerPoint
Waktu retensi senyawa diukur menggunakan deteksi serapan UV (kiri) dan deteksi indeks bias (RID) (kanan).
Kalibrasi : Kuantifikasi produk oksidasi gliserol dilakukan dengan menggunakan kurva kalibrasi berdasarkan respons spektrofotometri UV dan RI dari standar berair dengan konsentrasi yang diketahui. Kurva kalibrasi dibuat dengan menganalisis waktu retensi senyawa individual pada berbagai konsentrasi, diikuti oleh campuran standar untuk memvalidasi kalibrasi. Konsentrasi harus dipilih berdasarkan komposisi yang diharapkan dari analit nyata dan mempertimbangkan batas deteksi detektor. Kurva kalibrasi tidak hanya perlu mempertimbangkan resolusi antara puncak yang berurutan, tetapi juga memvalidasi parameter seperti linearitas kurva kalibrasi, presisi intra-hari, akurasi, sensitivitas, deteksi, dan batas kuantifikasi. [ 124 ] Penelitian yang relevan untuk kuantifikasi turunan gliserol tidak memiliki protokol kalibrasi standar, yang dapat menyebabkan masalah dalam pemisahan dan integrasi puncak. Peneliti harus melaporkan kromatogram kalibrasi dan kurva kalibrasi mereka seperti pada Gambar 7 untuk mengklarifikasi efektivitas kalibrasi mereka dengan resolusi puncak yang tinggi, pemisahan berbagai spesies yang baik, dan linearitas kurva kalibrasi.
Pengumpulan sampel : Pengasaman sampel yang dikumpulkan diperlukan untuk menyesuaikan pH operasi kolom yang digunakan untuk mendeteksi produk oksidasi gliserol. Misalnya, kolom Aminex HPX-87H memerlukan pH yang dipertahankan antara 1 dan 3. Selain itu, degradasi gliserol melalui zat antara yang tidak stabil dapat terjadi dalam kondisi basa pada suhu ruangan atau dalam kondisi asam pada suhu tinggi. Oleh karena itu, stabilisasi sampel elektrolit yang dikumpulkan biasanya dicapai dengan pengasaman dengan asam sulfat, yang penting untuk mengurangi degradasi sebelum analisis HPLC.
Namun, metode ini tidak sepenuhnya mencegah dekomposisi produk yang tidak diinginkan atau mengatasi ketidaksesuaian skala waktu yang melekat antara pengukuran elektrokimia dan teknik kromatografi. Untuk memungkinkan analisis produk yang hampir seketika dari reaksi elektrokimia, Garcia et al. [ 69 ] dan Kwon et al. [ 34 , 81 ] melaporkan pengumpulan sampel online yang cepat dengan ujung pengambilan sampel yang ditempatkan dekat dengan permukaan elektroda, memasukkan asam sulfat secara terus-menerus sebagai fase mobil dan dengan fraksi sampel yang dikumpulkan kemudian dianalisis dengan HPLC offline. Meskipun demikian, metode pengambilan sampel online ini masih tidak dapat mendeteksi gliseraldehida karena ketidakstabilannya dalam kondisi basa.
Keterbatasan teknik kromatografi : Teknik kromatografi untuk memahami mekanisme reaksi atau mengidentifikasi produk reaksi masih terbatas karena waktu analisis yang lama dalam kolom, dan penerapan utamanya adalah untuk eksperimen elektrolisis massal yang berlangsung lama yang mungkin tidak terlalu berguna dalam mempelajari jalur reaksi dan mekanisme waktu nyata pada tingkat molekuler.
3.3.2 Teknik Spektroskopi
Teknik operando , khususnya spektroskopi inframerah dan Raman yang ditingkatkan permukaan (SEIRAS dan SERS) mulai digunakan untuk menyelidiki pembentukan dan pengembangan adsorbat secara real-time untuk memahami mekanisme reaksi, berkat resolusi waktu yang tinggi (detik untuk IR dan hingga beberapa milidetik untuk Raman), sifat tidak merusak, dan sensitivitas terhadap unsur-unsur ringan yang dipadukan dengan teknik kromatografi. Peningkatan permukaan disediakan oleh resonansi plasmon dari lapisan tipis logam berstruktur nano, dan, untuk permukaan yang sangat optimal, faktor peningkatan total dapat mencapai ≈10 3 , yang memungkinkan deteksi zat antara reaksi pada konsentrasi yang sangat rendah. Spektroskopi Raman kurang sensitif terhadap air, dibandingkan dengan spektroskopi inframerah, yang menggunakan refleksi total yang dilemahkan untuk mengurangi sinyal elektrolit. [ 130 ] Teknik ini menggunakan kristal optik (seringkali ZnSe atau Si) yang aktif IR di wilayah spektral bawah, membatasi batas bawah hingga sekitar 1000 cm −1 . Dibandingkan dengan IR, Raman menawarkan resolusi waktu yang lebih cepat (hingga beberapa milidetik [ 131 ] ) dan resolusi spasial, yang sangat berguna untuk mengidentifikasi sensitivitas terhadap struktur elektroda dan lingkungan antarmuka. Meskipun demikian, SEIRAS lebih umum digunakan untuk mempelajari oksidasi gliserol karena rasio signal-to-noise yang lebih tinggi dan pilihan logam yang lebih luas untuk peningkatan permukaan.
Sejauh ini, inframerah dan Raman telah digunakan secara bergantian, dengan asumsi bahwa kedua teknik tersebut akan menghasilkan informasi yang sama untuk spesies yang terlihat dalam kedua kasus. Namun, sebuah studi baru-baru ini telah menunjukkan bagaimana teknik-teknik ini mampu menyelidiki situs-situs adsorpsi yang berbeda, khususnya pada logam-logam yang mengikat CO secara lemah seperti Au dan menyoroti komplementaritas dari teknik-teknik ini. [ 132 ]
Terlepas dari tekniknya, beberapa aspek membuat perolehan dan interpretasi data menjadi menantang.
Koreksi latar belakang : Mengingat perubahan spektral kecil yang disebabkan oleh zat antara reaksi, dibandingkan dengan sinyal inframerah total, koreksi latar belakang biasanya dilakukan. Set data perlu dikoreksi dengan spektrum referensi yang sama, untuk menyoroti perubahan yang bergantung pada potensial yang disebabkan oleh zat antara reaksi atau akumulasi spesies di antarmuka. Spektrum referensi yang paling umum digunakan adalah yang diperoleh pada potensial rangkaian terbuka (OCP), dengan adanya elektrolit yang mengandung gliserol. Pilihan ini memungkinkan untuk menghilangkan sinyal khusus elektrolit dan untuk mengisolasi puncak yang disebabkan oleh pembentukan zat antara reaksi yang didorong oleh potensial. Namun, hal ini dapat mengaburkan informasi mengenai adsorbat turunan gliserol yang terbentuk secara kimia pada OCP, terkadang menyebabkan munculnya puncak negatif, atau pembentukan dua puncak positif dan negatif yang berdekatan. Yang terakhir dapat menjadi hasil dari penyetelan tajam spesies yang terbentuk secara kimia, tanpa perubahan dalam cakupannya, tetapi dapat secara keliru ditafsirkan sebagai pembentukan simultan dari satu spesies dan konsumsi spesies lain. Oleh karena itu, disarankan untuk memperoleh spektrum referensi tanpa adanya gliserol.
Penetapan puncak : Aspek paling menantang dalam penggunaan operando Raman atau IR untuk mendeteksi zat antara reaksi adalah penetapan puncak. Kelompok fungsional yang berbeda memiliki vibrasi spesifik yang membantu penetapan puncak dalam spektrum IR. Misalnya, *CO yang teradsorpsi, dicirikan oleh ikatan rangkap tiga CO, menampilkan sinyal khas sekitar 2000 dan 1800 cm −1 , untuk bentuk ikatan linier dan ikatan jembatannya; sementara itu, mode tekukan air H─O─H diamati pada 1600 cm −1 . Namun, dalam kasus gliserol, penetapan menjadi rumit karena: i) berbagai mode adsorpsi gliserol, ii) berbagai macam produk yang mungkin, iii) kurangnya konsensus mengenai sifat zat antara, dan iv) kesamaan kelompok fungsional, yang mengarah pada kesamaan spektral dalam beberapa produk. Gliserol dapat diadsorpsi dengan berkoordinasi dengan atom oksigen atau karbon, yang dapat menghasilkan beberapa konfigurasi ikatan permukaan, termasuk karboksilat, aldehida, keton, asil, aldehida, dan karbonat. Semua gugus ini menunjukkan puncak karakteristik dalam kisaran 1100–1750 cm −1 dan terdapat dalam produk yang umum dilaporkan, seperti asam gliserat, asam glikolat, asam laktat, gliseraldehida, dan sebagainya. Untuk mendapatkan gambaran tentang tantangan tersebut, Tabel 5 memberikan gambaran umum tentang puncak yang ditetapkan yang dilaporkan dalam literatur. Selain mempersulit penugasan, hal ini juga dapat menyebabkan tumpang tindihnya puncak yang berbeda, sekitar 1700 cm −1 .
Tabel 5. Gambaran umum puncak yang ditetapkan dalam literatur.
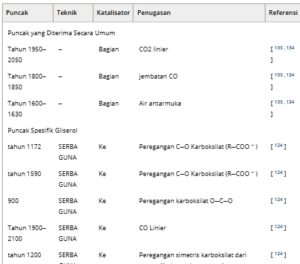
Meskipun demikian, penugasan yang andal dapat diperoleh dengan menggabungkan pendekatan yang berbeda, termasuk penggunaan reaksi yang disederhanakan, kalkulasi teoritis, dan pelabelan isotop. Pertama, sistem model dapat digunakan untuk mengisolasi spektrum zat antara tertentu, menghilangkan sebagian besar kompleksitas yang berasal dari oksidasi gliserol. Contoh-contoh sepele termasuk identifikasi puncak yang terkait dengan elektrolit, seperti air antarmuka (1600 cm −1 ), adsorpsi kation/anion spesifik, atau spesies *CO yang teradsorpsi, dengan penggunaan gas CO. [ 83 , 140 – 142 ] Perbandingan puncak *CO yang berasal dari gliserol yang diamati dengan posisi yang diharapkan dari gas CO juga dapat mengungkapkan informasi penting mengenai lingkungan sekitar *CO. [ 143 ] Lebih spesifik pada kasus elektrooksidasi gliserol, perbandingan spektrum yang diperoleh dari oksidasi GALD atau DHA dapat membantu mengidentifikasi mode pengikatan awal gliserol, sementara literatur luas yang tersedia tentang karakterisasi operando reduksi CO 2 [ 144 ] dan oksidasi asam format [ 133 , 138 , 139 , 145 ] dapat membantu mengidentifikasi puncak yang terkait dengan oksidasi dalam gliserol menjadi format, karbonat, dan karbon dioksida.
Pelabelan isotop adalah alat lain yang ampuh untuk penugasan puncak SEIRAS atau SERS. Pendekatan ini terdiri dari penggantian atom dalam elektrolit atau gliserol, dengan bentuk berlabel isotop (H/D, O16 / O18 , dan C12 / C13 ) . Karena frekuensi getaran secara langsung bergantung pada massa atom yang berosilasi, pergeseran posisi puncak menunjukkan keberadaan atom yang diinginkan, dan asal-usulnya (elektrolit vs. gliserol). Selain membantu penugasan puncak, pelabelan isotop dapat mendekonvolusikan puncak yang tumpang tindih.
Akhirnya, simulasi DFT dan bilangan gelombang vibrasi aktif inframerah dapat digunakan untuk mengonfirmasikan penetapan mode vibrasi. [ 144 , 146 ] Karena posisi pita sering kali tidak diprediksi secara tepat (±50 cm −1 ), perhitungan teoritis saja tidak cukup untuk menetapkan puncak secara andal. Meskipun demikian, perhitungan tersebut dapat membantu mengidentifikasi perantara yang masuk akal dan, untuk perantara yang tersolvasi serupa, jarak antara puncak dapat menjadi sumber informasi yang lebih andal.
Bahkan ketika menggabungkan semua teknik ini, penugasan sering kali terbatas pada gugus fungsi (misalnya peregangan C─O pada karboksilat), yang dapat mewakili beberapa zat antara reaksi (dalam contoh ini asam glikolat, asam laktat, asam format, dll.). Oleh karena itu, meskipun SERS dan SEIRAS dapat menjadi alat yang ampuh dan unik untuk menyelidiki mekanisme oksidasi gliserol, kehati-hatian perlu dilakukan dalam penafsiran spektrum.
Sebaliknya, spektroskopi IR refleksi total yang dilemahkan (ATR-FTIR) memungkinkan deteksi produk reaksi fase cair secara langsung, bukan zat antara yang terbentuk di permukaan. Hasilnya, identifikasi produk dapat lebih mudah, karena spektrum dapat langsung dibandingkan dengan produk yang diharapkan dalam elektrolit. Namun, puncak yang tumpang tindih di wilayah sidik jari tetap menjadi batasan yang signifikan (seperti yang ditunjukkan pada Tabel 5 ), terutama ketika terdapat beberapa produk.
3.3.3 Teknik Lain untuk Deteksi dan Kuantifikasi Produk
Resonansi magnetik nuklir (NMR) : NMR melibatkan interaksi inti atom yang mengandung momen magnetik bukan nol, seperti isotop 1H dan 13C , dengan medan magnet eksternal untuk menghasilkan sinyal resonansi. [ 147 ] Sinyal-sinyal ini sesuai dengan lingkungan kimia yang berbeda dari setiap inti dan dipisahkan oleh pergeseran kimia. Untuk NMR 1H , luas di bawah sinyal sebanding dengan jumlah proton yang terkait dan dapat diintegrasikan untuk analisis kuantitatif. Untuk NMR 1H kuantitatif relatif menggunakan standar internal, persamaan berikut digunakan untuk menemukan rasio molar senyawa X dan Y:
mathematical equation
di mana M adalah jumlah mol, I adalah luas integral puncak dan N adalah jumlah proton (inti) yang direpresentasikan oleh puncak terintegrasi.
Oleh karena itu, metode ini dapat digunakan untuk mengukur kuantitas produk oksidasi gliserol. NMR dapat mentoleransi berbagai pH, dan umumnya sampel hanya memerlukan penambahan sedikit pelarut terdeuterasi. [ 148 ]
Campuran produk yang kompleks dapat memberikan sinyal yang tumpang tindih dalam spektrum 1H karena rentang pergeseran kimia yang kecil. 13C dapat digunakan bersama dengan 1H , untuk menyebarkan pergeseran kimia dan memisahkan sinyal. Namun, kuantifikasi 13C memiliki keterbatasan karena rendahnya kelimpahan isotop alami dan sensitivitas yang rendah. Meskipun demikian, kemajuan terkini dalam pengembangan magnet medan tinggi dan teknologi CryoProbe telah meningkatkan sensitivitas, membuka kemampuan untuk melakukan analisis kuantitatif NMR 13C . [ 149 ]
Sampai saat ini, ada beberapa studi elektro-oksidasi gliserol dengan kuantifikasi NMR lengkap dari produk, dengan sebagian besar menggabungkan NMR kualitatif dan HPLC [ 41 , 150 , 151 ] atau melaporkan informasi NMR kuantitatif yang terbatas, analisis data dan spektrum. [ 152 – 154 ] Kirici dkk. [ 148 ] melakukan studi ekstensif ke dalam penggunaan 1 H NMR untuk kuantifikasi elektro-oksidasi gliserol penuh. Penggunaan standar internal untuk kuantifikasi ditemukan lebih dapat diandalkan daripada kurva kalibrasi. Mengukur beberapa produk masih menjadi tantangan; asam oksalat dan asam mesoksalat dideprotonasi dalam larutan berair dan hanya terdeteksi oleh 13 C NMR. Seperti yang diharapkan, hanya produk dekomposisi yang terdeteksi untuk gliseraldehida yang tidak stabil. Dalam kondisi basa, puncak asam glikolat tumpang tindih dengan puncak satelit 1 H gliserol ; pengasaman memungkinkan pemisahan puncak. Secara keseluruhan, bila dibandingkan dengan HPLC, NMR mengidentifikasi produk tambahan tetapi menghasilkan perbedaan >10% dalam total efisiensi Faradaic yang dihitung.
Kelompok lain telah mengeksplorasi penggunaan 13 C NMR: Huang dan rekan-rekannya [ 155 ] menerapkan 13 C NMR in-situ . Mereka merekam produk elektrooksidasi gliserol pada Pt/C, PtRu/C, dan PtRh/C pada potensial aktif dan mendasarkan analisis kuantitatif mereka pada faktor sensitivitas puncak 13 C dari setiap produk dibandingkan dengan gliserol. Sementara, mereka mengidentifikasi perbedaan dalam selektivitas dan mekanisme produk pada potensial yang lebih tinggi, beberapa pengukuran potensial rendah memberikan rasio signal-to-noise yang buruk. Secara terpisah, Nguyen dan rekan-rekannya [ 156 ] membandingkan 13 C NMR dengan HPLC. Mereka mengklaim bahwa NMR mengurangi masalah dengan campuran kompleks dan sinyal yang tumpang tindih tetapi menunjukkan deviasi yang lebih besar dari konsentrasi nyata dibandingkan dengan HPLC. Karena waktu akuisisi 13 C adalah 48 jam per sampel, hanya satu sampel yang dijalankan untuk penelitian mereka.
Satu produk oksidasi gliserol yang umumnya diabaikan adalah karbonat. Wang et al. [ 157 ] melaporkan defisiensi keseimbangan karbon hingga 28% setelah analisis HPLC pada elektrokatalis Pd. Mereka menghubungkan hal ini dengan karbonat atau CO 2 yang tidak terdeteksi dari konversi asam format, dan mendeteksi karbonat pada 168 ppm menggunakan 13 C NMR non-kuantitatif . Dalam studi yang berbeda, Marchionni et al. [ 158 ] melaporkan produksi karbonat dengan selektivitas hingga 28,8%, juga pada elektrokatalis berbasis Pd. Mereka menggabungkan kromatografi ion (IC) dan 13C{1H}-NMR untuk mengkuantifikasi semua produk, tetapi rincian tentang metode analisis mereka tidak dilaporkan. Sebaliknya, Ke et al. [ 159 ] mengeksplorasi katalis berbasis Co, dan mengklaim bahwa karbonat yang diidentifikasi melalui 13 C NMR berasal dari CO 2 atmosfer terlarut . Secara keseluruhan, studi NMR ini menunjukkan ketidakkonsistenan mengenai pembentukan karbonat, metode yang digunakan dan hilangnya informasi penting dalam analisis data.
Kromatografi ion (IC) : IC digunakan untuk analisis campuran ionik dalam larutan berair. [ 160 ] Mirip dengan kromatografi cair, eluen yang mengandung campuran komponen dilewatkan melalui kolom dan dipisahkan, memungkinkan kuantifikasi anion dan kation. Karena IC dapat memisahkan asam organik dan anion anorganik, ia menawarkan metode kuantifikasi alternatif untuk HPLC atau 1 H NMR. Namun, hingga saat ini, hanya sedikit studi elektro-oksidasi alkohol yang dilaporkan menggunakan IC. [ 158 , 161 ] Chen dan rekan kerja [ 161 ] menggunakan IC, dilengkapi dengan kolom Dionex AS11-HC untuk mendeteksi asetat dan karbonat untuk oksidasi etanol. Sementara karbonat tidak dapat dideteksi, karena konsentrasi rendah atau sensitivitas kolom, masih ada ruang untuk kuantifikasi produk menggunakan IC.
4 Pelaporan Data
Sampai saat ini belum ada metode standar untuk melaporkan selektivitas elektrokatalis elektrooksidasi gliserol, terutama karena sifat kompleks dari jalur reaksi. Misalnya, efisiensi Faradaic, ditentukan oleh Persamaan ( 1 ):
![]()
di mana s A adalah faktor stoikiometri produk A, n A adalah jumlah molar A yang diproduksi, z adalah jumlah elektron yang ditransfer untuk produk A, F adalah konstanta Faraday, dan Q adalah total muatan yang dilewatkan. Efisiensi Faradaic mengabaikan fakta bahwa produk tertentu (misalnya, asam laktat) melalui langkah elektrokimia dan kimia gabungan. Oleh karena itu, hanya pelaporan efisiensi Faradaic tidak dapat secara akurat mewakili jumlah gliserol yang diubah menjadi asam laktat. Contoh lain adalah asam gliserat. Dalam media alkali, ia dapat dibentuk melalui langkah elektrokimia empat elektron, atau melalui pembentukan gliseraldehida dua elektron melalui reaksi Cannizzaro, sehingga sulit untuk menetapkan stoikiometri elektron pada produk ini. Di sisi lain, dengan mengadaptasi metode perhitungan selektivitas dari termo-katalisis, Persamaan ( 2 ):
![]()
tidak dapat mencerminkan muatan yang diperlukan untuk menghasilkan produk tertentu. Meskipun demikian, kedua metode tersebut kini lebih diterima secara luas oleh komunitas elektrooksidasi gliserol, seperti yang terlihat dalam banyak publikasi terkini. [ 12 , 46 , 62 , 121 ]
Salah satu manfaat yang jelas dari standarisasi pelaporan data adalah untuk memfasilitasi perbandingan intra-laboratorium. Sebelumnya, metode yang banyak digunakan oleh masyarakat untuk kuantifikasi distribusi produk melalui Persamaan ( 3 ):
![]()
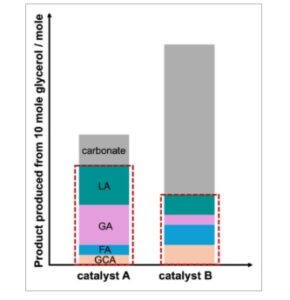
Perhitungan tersebut memiliki kelemahan yang signifikan, karena keakuratannya bergantung pada seberapa kaku metode deteksi produk, dan berapa banyak produk yang telah dikuantifikasi. Karena analisis produk sebagian besar dilakukan dengan HPLC, yang tidak mampu mendeteksi karbonat, perhitungan tersebut dapat menyebabkan kesalahan besar. Untuk memberikan contoh sederhana pada Gambar 8 , dalam kedua kasus distribusi produk asam laktat adalah 40%, namun jumlah gliserol yang diubah menjadi asam laktat telah berkurang hingga 50%.
Gambar 8
Buka di penampil gambar
Presentasi PowerPoint
Ilustrasi sederhana dari kekurangan perhitungan distribusi produk. Dengan katalis A, 10 mol gliserol diubah menjadi 3 mol karbonat/CO 2 , 4 mol asam gliserat, 4 mol asam laktat, 1 mol asam format, dan 1 mol asam glikolat, distribusi produk asam laktat adalah 40%. Dengan katalis B, 10 mol gliserol diubah menjadi 15 mol karbonat/CO 2 , 2 mol asam gliserat, 2 mol asam laktat, 2 mol asam format, dan 2 mol asam glikolat. Area yang ditandai mewakili produk yang dapat diukur melalui HPLC. LA: asam laktat, GA: asam gliserat, FA: asam format, GCA: asam glikolat. Produk lain seperti asam tartronik, asam oksalat, dan asam mesoksalat juga dapat hadir, tetapi demi kesederhanaan, mereka tidak ditampilkan di sini.
Selain pelaporan selektivitas, keseimbangan karbon, ditentukan oleh Persamaan ( 4 ):
![]()
Tetap menjadi faktor penting, karena memberikan indikasi berapa banyak gliserol yang hilang dalam sistem, baik dengan diubah menjadi produk yang tidak dapat diukur (misalnya, karbonat), atau dengan tetap berada di reaktor dan dengan demikian tidak dapat diwakili secara akurat oleh Gliserol akhir – Gliserol awal .
5 Kesimpulan
Dalam makalah ini, kami menyoroti tantangan dalam memahami mekanisme reaksi dan mengendalikan faktor-faktor untuk elektrooksidasi gliserol karena distribusi produknya yang kompleks, berbagai konfigurasi pengikatan, zat antara yang tidak stabil (misalnya, gliseraldehida dan DHA), dan koeksistensi jalur Faradaik dan non-Faradaik. Teknik spektroskopi dan kromatografi seperti SEIRAS dan HPLC telah digunakan untuk menganalisis zat antara dan produk untuk mendapatkan wawasan tentang mekanisme reaksi. Namun, keterbatasan dalam penugasan puncak, resolusi puncak, pengoptimalan parameter analisis, dan validasi data jarang dibahas dalam literatur. Identifikasi dan kuantifikasi semua turunan gliserol dengan akurasi tinggi masih menjadi tantangan. Berikut ini adalah pesan-pesan yang dapat diambil:
Pengembangan elektrokatalis harus didukung oleh metode yang andal untuk mengevaluasi kinerja elektrokimia yang dapat diskalakan dan dipindahkan dari sistem skala RDE ke MEA.
RDE banyak digunakan untuk penyaringan aktivitas elektrokatalitik cepat dengan jumlah katalis minimal dan untuk mempelajari kinetika karena permukaannya halus dan datar.
Pengukuran MEA memberikan gambaran representatif tentang kinerja perangkat yang sebenarnya (misalnya, sel bahan bakar atau elektroliser) tetapi tidak cocok untuk evaluasi aktivitas karena potensi elektroda individual tidak dapat ditentukan. Memasukkan elektroda referensi ke dalam MEA dapat mengatasi keterbatasan ini.
Pembandingan terhadap katalis yang dipelajari secara luas dengan prosedur yang mapan untuk pengukuran elektrokimia sangat penting untuk memastikan perbandingan karakteristik elektrokimia di seluruh penelitian.
Untuk pembandingan, RDE direkomendasikan. Cakram platinum atau emas polikristalin, atau nanopartikel Pt/C atau Au/C komersial yang diendapkan pada cakram karbon kaca datar dan halus adalah yang ideal, karena pengaruh minimal dari kekasaran permukaan substrat.
Validitas pengukuran elektrokimia, seperti CV, dan kondisi pengaturan (misalnya, kebersihan) dapat diverifikasi dengan membandingkan pengukuran kosong bahan acuan (misalnya, polikristalin Pt RDE atau nanopartikel Pt/C) dengan profil CV kosong yang dilaporkan dalam literatur. [ 109 – 111 ]
Prosedur yang direkomendasikan untuk persiapan elektroda, pembersihan permukaan katalis, dan pengukuran CV menggunakan Pt/C telah ditetapkan untuk OER. [ 91 , 96 ]
Sel tipe H, seperti yang dilaporkan oleh Dai et al., [ 121 ] dengan dua kompartemen yang dipisahkan oleh membran pertukaran ion, lebih disukai. Pengaturan ini mengisolasi elektroda lawan untuk mencegah reaksi balik produk, dan ini menghindari pelindian ion Cl − dari elektroda referensi yang mengandung Cl atau logam terlarut dari elektroda lawan untuk mengganggu pengukuran.
Elektrolit pendukung dengan kemurnian tinggi (misalnya, bahan kimia kelas Merck Suprapur), pembersihan sel yang tepat, [ 91 , 96 ] dan bahan sel yang tepat (misalnya, kaca untuk kondisi asam dan PTFE untuk kondisi basa) harus digunakan untuk menghindari kontaminasi dan penggoresan peralatan gelas.
Peneliti harus memberikan spesifikasi terperinci tentang pengaturan, kondisi, dan metodologi eksperimen untuk mengevaluasi aktivitas elektrokimia, stabilitas katalis, dan standar kalibrasi untuk kuantifikasi produk menggunakan HPLC.
Kromatogram dan kurva kalibrasi untuk analisis HPLC harus dilaporkan dalam informasi pendukung untuk menunjukkan efektivitas kalibrasi, termasuk resolusi puncak, pemisahan berbagai spesies, dan linearitas kurva kalibrasi.
Konsistensi dalam pelaporan data eksperimen, terutama mengenai selektivitas produk, juga penting tetapi sering diabaikan.
Disarankan untuk menggunakan beberapa metode kuantifikasi komplementer guna mencapai analisis produk yang komprehensif. Misalnya, menggabungkan HPLC dengan analisis SEIRAS dan NMR dapat membantu mengonfirmasi keberadaan spesies permukaan yang tidak stabil selama reaksi dan pembentukan karbonat.
Kendala tambahan meliputi produksi selektif produk target—yang diperumit oleh jalur elektrokimia dan termokimia yang saling bersaing yang mengakibatkan distribusi produk yang luas—dan penonaktifan katalis, khususnya pada logam mulia, karena penyerapan kuat spesies beracun seperti CO. Meskipun ada upaya substansial dalam pengembangan katalis, mencapai selektivitas tinggi untuk satu produk yang diinginkan dan mempertahankan aktivitas katalitik jangka panjang tetap menjadi tantangan yang belum terselesaikan.
Untuk lebih mengintegrasikan pembelajaran mesin (ML) untuk penemuan cepat elektrokatalis yang efektif dan pengoptimalan kondisi reaksi, [ 162 , 163 ] eksperimen elektrokimia otomatis merupakan strategi yang menarik untuk mencapai operasi eksperimen yang presisi, pembuatan dan analisis data yang cepat. Elektrolisis dengan hasil tinggi dapat secara signifikan meningkatkan efisiensi proses dari sintesis material hingga karakterisasi, yang melibatkan perakitan sel MEA dan pengukuran elektrokimia untuk aktivitas katalis, stabilitas, dan analisis produk.
Penggabungan lebih lanjut oksidasi gliserol elektrokimia dengan reaksi katoda, seperti reaksi reduksi CO 2 (CO 2 RR) atau HER, dalam elektroliser semakin menarik karena berkurangnya energi masukan untuk pembentukan produk bernilai tambah secara simultan di kedua sisi sel. Dengan mempertimbangkan kelayakan ekonomi oksidasi gliserol elektrokimia, penting untuk mengakui bahwa konsumsi elektrolit alkali dan asam yang digunakan untuk netralisasi berkontribusi pada peningkatan biaya operasional. [ 164 ] Hal ini menyoroti arah utama untuk penelitian di masa mendatang: pengembangan bahan katalitik dan penyelidikan kondisi operasi yang efektif dan praktis dalam lingkungan yang lebih basa, netral, atau asam. Selain itu, mengintegrasikan sistem elektrodialisis dengan elektrooksidasi gliserol menghadirkan strategi yang menjanjikan untuk memulihkan alkali secara elektrokimia dari elektrolit yang sangat basa, yang memungkinkan penggunaan kembali secara langsung tanpa pengolahan tambahan. [ 165 , 166 ] Sistem tersebut telah digunakan untuk mencapai pemisahan produk dan pemulihan KOH, dengan hasil K⁺ yang dilaporkan sebesar 94%. [ 166 ]
Yang terakhir namun tidak kalah pentingnya, upaya penelitian diperlukan untuk menangani pengolahan hulu gliserol mentah langsung dari industri biodiesel dan potensi pemisahan hilir untuk mengisolasi produk tertentu dari jumlah besar.

