
Abstrak Grafis
Reaktivitas spesifik isomer merupakan kunci dalam kimia klaster. Di sini, ditunjukkan bagaimana menggabungkan mobilitas ion tabung apung dengan spektrometri massa memungkinkan derivasi koefisien laju reaksi untuk koeksistensi
isomer, membuka jalan baru untuk mempelajari sistem kimia yang kompleks.
Abstrak
Membedakan reaktivitas kimia isomer merupakan tantangan mendasar dalam kimia, khususnya dalam kimia klaster, di mana jumlah struktur yang mungkin meningkat secara dramatis seiring dengan ukuran klaster. Studi ini menyajikan pendekatan baru untuk mengukur kinetika reaksi ion-molekul spesies yang dihilangkan laser dengan cara yang spesifik terhadap isomer. Hal ini dicapai dengan menggabungkan mobilitas ion tabung apung dengan spektrometri massa, yang memungkinkan pemilihan bentuk sebelum menyelidiki reaktivitas kimia spesies yang diinginkan. Pertama, kemampuan memperoleh koefisien laju reaksi dengan mempelajari reaksi adisi nukleofilik dari cincin karbon dengan piridina, membandingkan hasil dengan nilai yang dilaporkan sebelumnya divalidasi. Kemudian kemampuan untuk menentukan koefisien laju reaksi spesifik isomer menggunakan
klaster, tempat beberapa isomer hidup berdampingan. Hal ini menyoroti potensi instrumen baru kami untuk secara akurat mengkarakterisasi reaktivitas spesifik isomer dalam sistem kimia yang kompleks.
1 Pendahuluan
Reaktivitas kimia secara inheren terkait dengan struktur molekul. Karena isomer yang berbeda dari spesies yang sama dapat menunjukkan reaktivitas yang berbeda, mengungkap perilaku kimianya dapat menjadi tugas yang rumit. Kimia klaster berfungsi sebagai contoh utama bidang di mana isu ini sangat penting. Seiring bertambahnya ukuran klaster, jumlah isomer stabil yang mungkin ada bersamaan meningkat secara dramatis, sehingga membuat analisis kimia menjadi menantang. Dalam konteks penelitian ini, contoh yang dipilih adalah kation klaster karbon, yang kimianya memainkan peran penting dalam proses pembakaran seperti pembentukan jelaga [ 1 ] dan dalam lingkungan antarbintang. [ 2 ]
Pengukuran mobilitas ion fase gas telah secara jelas mengungkapkan bahwa
klaster mengadopsi bentuk struktur yang berbeda tergantung pada rentang massanya: isomer linier untuk n = 3–10,
[ 3 ] Menariknya, koeksistensi struktur linier dan cincin untuk gugus karbon dari
awalnya disimpulkan dari studi reaktivitas fase gas. Studi ini mengungkapkan bahwa gugus linier bereaksi cepat dengan H 2 , D 2 , O 2 , dan hidrokarbon, sedangkan gugus siklik menunjukkan sedikit atau tidak ada reaktivitas dengan spesies netral ini. [ 4 – 6 ] Temuan ini menjelaskan mengapa dua rentang ukuran tertentu diselidiki: antara
Dan
, dimana struktur monosiklis secara eksklusif terbentuk [ 7 – 10 ] dan seterusnya
, di mana fullerene muncul secara dominan. [ 11 – 13 ] Hal ini menyoroti bahwa, untuk gugus karbon kationik, penyelidikan rentang ukuran menengah pasti akan memerlukan pengaturan eksperimental yang mampu mengisolasi isomer tertentu sebelum mempelajari reaktivitasnya. Pendekatan semacam itu penting untuk mengurai sifat kimia dari masing-masing isomer.
Metode pertama, yang diusulkan oleh McElvany, [ 4 ] bergantung pada pendekatan MS3 (tiga langkah isolasi massa berturut-turut), yang memanfaatkan perbedaan reaktivitas antara isomer linier dan siklik dari
terhadap D 2 , untuk mempelajari reaksi antara c − C 7 + dan asetilena. Ion induk pertama-tama dipilih massanya dan dimasukkan ke dalam sel spektrometer massa transformasi Fourier dengan campuran C 2 H 2 dan D 2 dengan kelebihan D 2 . Tahap pemilihan massa kedua digunakan untuk mengisolasi populasi siklik yang tidak reaktif. Akhirnya, produk reaksi antara ion yang dipilih dan asetilena dianalisis massanya. Namun, teknik ini tidak cocok sebagai metode universal, karena memerlukan reaktan dengan reaktivitas yang cukup berbeda terhadap setiap isomer yang hidup berdampingan.
Teknik yang lebih langsung bergantung pada penggabungan mobilitas-pemisahan ion dengan pengukuran reaktivitas, yang memungkinkan pemilihan berdasarkan penampang lintang tumbukan (CCS). Pendekatan ini pertama kali digunakan oleh Von Helden pada reaksi gugus yang mengandung 3–15 atom karbon dengan O 2 dan NO. [ 3 ] Koefisien laju mereka ditentukan dengan menambahkan gas yang bereaksi di dalam sel drift. Dengan menggunakan pendekatan yang sebanding, Misaizu et al. telah menunjukkan dalam penelitian mereka bahwa mereka dapat mengurai kimia struktur linear dan siklik gugus yang mengandung 4–9 atom karbon dengan D 2 . [ 14 ] Namun, metode ini memberikan kontrol yang tidak sempurna atas waktu drift dan, akhirnya, pemilihan mobilitas ion, karena reaktivitas terjadi di sepanjang wilayah drift.
Di luar kerangka kimia klaster, Shiels et al. menggunakan pemisahan mobilitas ion asimetris medan (FAIMS) untuk mencapai tujuan tersebut dengan menguji reaktivitas dua protomer diazanaphthalene dengan etilena secara individual. [ 15 ] Hal ini mengatasi masalah karena ion dipisahkan sebelum pengukuran reaktivitas. Namun, teknik FAIMS memiliki keterbatasan yang melekat, yaitu ketidakmampuannya untuk memperoleh pengukuran CCS secara langsung, yang menghambat identifikasi langsung banyak spesies yang tidak diketahui yang hidup berdampingan.
Oleh karena itu, kombinasi reaktivitas ion-molekul dalam perangkap ion, mengikuti pemilihan bentuk menggunakan pengaturan mobilitas ion tabung apung, tampaknya merupakan teknik yang paling cocok.
Dalam artikel ini, kami menyajikan peralatan baru yang dirancang untuk mempelajari reaksi ion-molekul spesifik isomer dan menentukan koefisien laju reaksi. Kemampuan ini ditunjukkan oleh contoh reaksi adisi nukleofilik piridina ( Pyr , C5H5N ) dengan berbagai isomer gugus karbon kationik.
2 Bagian Eksperimen
Spektrometer massa-mobilitas ion tandem baru ini secara konseptual mirip dengan instrumen yang dikembangkan oleh kelompok Bieske. [ 16 , 17 ] Spektrometer ini menyediakan dua dimensi seleksi ortogonal untuk mengidentifikasi dan membedakan isomer berdasarkan CCS dan rasio massa terhadap muatan. Alur kerja dan representasi skematis dari pengaturan eksperimen disajikan dalam Gambar 1. Peralatan ini terdiri dari empat bagian: 1) sumber ablasi laser, 2) daerah drift, 3) oktupol, dan 4) filter massa kuadrupol (QMF). Komponen-komponen ini akan dijelaskan secara individual di bawah ini.
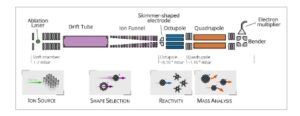
Gambar 1
Buka di penampil gambar
Representasi skematis dari pengaturan dan pendekatan empat langkah untuk pengukuran reaktivitas: (1) pembangkitan ion, (2) pemilihan bentuk, (3) reaktivitas, dan (4) analisis massa.
2.1 Sumber Ion
Ion dihasilkan oleh penguapan laser pada batang target grafit (Goodfellow) menggunakan harmonik kedua dari laser Nd:YAG (Centurion+, laser Quantel) pada 532 nm, dengan daya tipikal 30 mJ per pulsa dan laju pengulangan yang dapat disesuaikan mulai dari 1 hingga 100 Hz, tergantung pada aplikasinya. Target berputar terus-menerus, dan sinar laser digerakkan secara vertikal oleh sekrup bermotor pada dudukan cermin terakhir di sepanjang batang untuk meminimalkan perubahan permukaan target sampel.
2.2 Pemilihan Daerah Drift dan Isomer
Daerah drift terdiri dari tumpukan ekstraksi lensa, tabung drift, dan corong ion yang berakhir pada elektroda berbentuk skimmer. Penurunan tegangan diterapkan di antara setiap komponen untuk memungkinkan pemisahan mobilitas ion. Gas penyangga nitrogen dimasukkan ke dalam daerah drift melalui flowmeter (SLA Series, Brooks Instruments) pada laju aliran 0,2 L min −1 , mempertahankan tekanan 1,5 mbar, dipantau oleh baratron (CMR 363, Pfeiffer Vacuum). Ruang dipompa oleh pompa putar (Edwards E2M28, Edwards Vacuum).
Tumpukan ekstraksi terdiri dari sembilan elektroda yang digandeng secara resistif untuk berfungsi sebagai pembagi tegangan. Batang target diposisikan di antara dua elektroda pertama. Medan yang biasanya diterapkan adalah 45 V cm −1 . Batang itu sendiri terpolarisasi pada tegangan rata-rata dari dua elektroda yang mengelilinginya, dan ruang diapungkan pada tegangan rata-rata seluruh tumpukan lensa untuk mencegah kerusakan listrik.
Komponen utama dari daerah drift adalah tabung kaca resistif (33 m Ω) sepanjang 30 cm dengan diameter dalam 40 mm (Photonis). Tabung ini biasanya dioperasikan pada medan listrik 35 V cm −1 .
Setelah melewati tabung drift, corong ion (IF) memastikan pemfokusan berkas ion yang baik untuk transfer dari daerah bertekanan tinggi ke daerah bertekanan rendah. Corong tersebut memiliki panjang 15,5 cm dan terdiri dari 28 elektroda papan sirkuit cetak yang dibor. Diameternya berkurang secara bertahap, dari 38,5 menjadi 7 mm. Elektroda tersebut dihubungkan oleh resistor 1 m Ω, dengan potensi yang sesuai diterapkan pada elektroda pertama dan terakhir untuk menciptakan medan drift homogen sebesar 10 V cm −1 . Elektroda tersebut juga digandeng secara kapasitif ke pasokan frekuensi radio (RF), dengan amplitudo penggerak sebesar 150 V pp dan frekuensi 1 MHz.
Elektroda berbentuk skimmer ujung yang terletak 1 mm setelah elektrode terakhir IF dapat berfungsi sebagai gerbang ion. Dengan menerapkan potensi pemblokiran, ia mencegah lewatnya ion, yang dapat dilepaskan sementara untuk durasi tertentu (biasanya 0,5 ms) pada penundaan yang ditentukan setelah tembakan laser (waktu drift). Hal ini memungkinkan pemilihan populasi ion tertentu yang sebelumnya telah dipisahkan oleh mobilitas ion. Elektrode ini juga digunakan sebagai dinding pemompaan diferensial antara wilayah drift dan ruang oktupol.
2.3 Panduan/Perangkap Ion Oktupol
Setelah keluar dari daerah drift, ion melewati perangkat RF oktupol sepanjang 51 mm yang terbuat dari batang berdiameter 2 mm dan dengan diameter dalam 6 mm. Perangkat ini memiliki beberapa tujuan: dapat berfungsi sebagai pemandu ion ke ruang vakum berikutnya, menyediakan tahap pemompaan diferensial yang efektif sebelum analisis massa, atau dapat digunakan untuk menjebak ion guna menyelidiki sifat reaktivitasnya. Ruang oktupol dipompa oleh dua turbopump dengan kecepatan pemompaan 380 dan 685 L s −1 untuk nitrogen (HiPace 450 dan 700, masing-masing, dari Pfeiffer Vacuum).
Tekanan di dalam ruang oktupol biasanya dipertahankan pada sekitar 6 × 10 −4 mbar. Hal ini dipantau menggunakan baratron (CMR 375, Pfeiffer Vacuum). Amplitudo RF yang diterapkan umumnya sekitar 100 V tetapi dapat disesuaikan tergantung pada m/z yang diinginkan. Frekuensi RF ditetapkan pada 1,7 MHz
Bahasa Indonesia: Bila digunakan sebagai perangkap ion, potensial pemblokiran/pelepasan diterapkan pada elektrode pertama setelah oktupol untuk menjebak ion-ion dalam medan listrik RF. Ruang diisi dengan campuran nitrogen dan gas reaktif. Jumlah kerapatan gas reaktif ditentukan berdasarkan tekanan parsial reaktan dalam aliran nitrogen yang dimasukkan ke dalam ruang oktupol. Untuk Pyr , kami mengalirkan nitrogen pada 2,2 bar ke dalam penggelembung yang diisi dengan piridina cair, kemudian memasukkannya ke dalam ruang melalui katup jarum. Tekanan uap piridina ditentukan dari persamaan Antoine, pada suhu 293 K (21 mbar). Campuran tersebut dianggap homogen, biasanya menghasilkan beberapa persen Pyr dalam N 2 .
2.4 Filter Massa Quadrupole dan Deteksi
Setelah melewati daerah mobilitas dan reaktivitas, ion dianalisis massanya oleh QMF sepanjang 250 mm, yang digerakkan oleh catu daya RF yang dibuat oleh JanasCard. QMF dapat dioperasikan dengan resolusi massa 1 unit massa atom hingga m/z 1800 (lihat Informasi Pendukung untuk keterangan lebih rinci). Kemudian ion dibelokkan dari sumbu oleh pembengkok kuadrupol dan dideteksi oleh pengganda elektron dengan dinode konversi (R6984-80, Hamamatsu). Sinyal ion diperoleh dengan mengumpulkan sinyal analog dari pengganda elektron dan divisualisasikan pada osiloskop.
3 Hasil dan Pembahasan
Pertama, kami menunjukkan cara menghasilkan ion gugus karbon dan membedakan isomernya. Selanjutnya, kami menunjukkan bagaimana, setelah memilih isomer yang diinginkan, studi kinetik dapat dilakukan pada isomer tersebut dalam perangkap ion.
3.1 Pembentukan Klaster Karbon
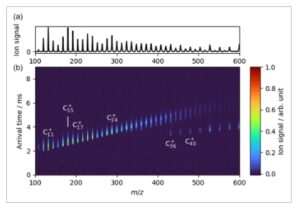
Spektrum mobilitas prototipe yang diperoleh dengan pengaturan yang dijelaskan ditunjukkan pada Panel b Gambar 2. Dalam plot kontur ini, dua dimensi seleksi (berdasarkan massa dan bentuk) diplot pada sumbu x dan y , berturut-turut. Setiap garis vertikal sesuai dengan distribusi waktu kedatangan (ATD) tunggal. Oleh karena itu, setiap titik pada plot kontur mewakili satu isomer pada rasio massa terhadap muatan tertentu dan dengan sebaran tertentu dalam waktu kedatangan, yang didefinisikan sebagai perbedaan waktu antara tembakan laser dan deteksi. Resolusi mobilitas tipikal adalah ≈20 seperti yang dapat dilihat dalam SI. Spektrum massa yang sesuai (integrasi pada setiap ATD) ditampilkan di Panel a. Tidak ada gating pada elektroda berbentuk skimmer atau trapping di oktupol yang dilakukan sehingga semua ion dikumpulkan tanpa diskriminasi.
Gambar 2
Buka di penampil gambar
Panel b menyediakan analisis massa dan bentuk gugus karbon
( n = 9–50) dihasilkan dari grafit yang dihilangkan dengan laser. Rasio massa terhadap muatan ( m/z ) disetel pada sumbu x , sedangkan ATD, yang menginformasikan tentang bentuk gugus, diplot pada sumbu y . Panel a menunjukkan spektrum massa yang sesuai (integrasi pada setiap ATD).
Tren linear dalam waktu kedatangan diamati seiring bertambahnya ukuran kluster, masing-masing sesuai dengan satu jenis struktur: sangkar, cincin monosiklis dan bisiklik. Struktur dominan untuk kluster dengan 20 atom karbon adalah cincin tunggal. Spesies bisiklik muncul untuk ukuran kluster antara 20 dan 30 atom. Di atas 30 atom, struktur sangkar dan cincin hidup berdampingan, struktur fulleren menjadi menonjol seiring bertambahnya ukuran kluster, tetapi hanya diamati untuk jumlah atom karbon yang genap. Fulleren terkecil yang terlihat dalam pengaturan kami adalah
Hasil ini sesuai dengan pengetahuan yang sudah ada mengenai distribusi ukuran dan bentuk gugus karbon yang dihasilkan oleh penguapan laser. [ 3 , 18 ]
3.2 Pengukuran Koefisien Laju Orde Kedua
Metodologi untuk memperoleh koefisien laju orde kedua pertama kali diuji menggunakan reaksi cincin karbon kecil (
Bahasa Indonesia dengan Pyr . Reaksi-reaksi ini dipilih karena dilaporkan dalam literatur, [ 10 ] dan hanya satu isomer gugus karbon yang diharapkan ada.
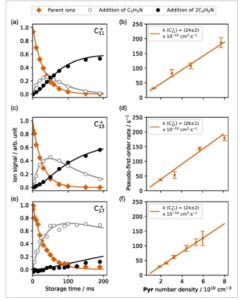
Hasilnya ditampilkan pada Gambar 3. Contoh profil kinetik disediakan untuk reaksi antara setiap gugus karbon dan Pyr (Panel a, c, dan e). Titik-titik oranye mewakili sinyal ion dari ion induk sebagai fungsi waktu penyimpanan. Titik-titik abu-abu dan hitam menunjukkan sinyal ion dari dua produk reaksi utama,
Dan
produk, masing-masing, sesuai dengan penambahan satu dan dua molekul Pyr . Karena biasanya hanya beberapa ribu ion yang terperangkap, Pyr hadir dalam jumlah yang sangat banyak (>10 10 molekul), yang memungkinkan reaksi diperlakukan sebagai orde pertama semu. Model kinetik dari dua penambahan berurutan digunakan untuk menginterpretasikan profil kinetik pembentukan produk. Namun, karena tidak semua saluran reaksi dipantau (seperti yang dibuktikan oleh jumlah total sinyal produk yang tidak konstan), tetapi hanya dua produk utama, laju reaksi yang diperoleh dari model ini untuk kemunculan produk tidak dapat digunakan untuk analisis kuantitatif. Namun, hilangnya induk sebagai fungsi waktu penyimpanan dapat disesuaikan dengan baik menggunakan peluruhan monoeksponensial, yang menyediakan laju reaksi orde pertama semu. Oleh karena itu, laju ini memperhitungkan jumlah semua saluran reaksi, dan dengan demikian hanya kecocokan ion induk yang digunakan untuk menyediakan laju reaksi di seluruh artikel ini.
Gambar 3
Buka di penampil gambar
Panel kiri (a, c, dan e): Profil kinetik reaksi dengan Pyr pada kerapatan nomor Pyr masing-masing 1,3, 1,5, dan 1,9 × 10 10 cm −3 . Titik oranye menunjukkan evolusi sinyal ion induk, sedangkan titik abu-abu dan hitam menunjukkan sinyal kedua produk. Panel kanan (b, d, dan f): Laju orde pertama semu sebagai fungsi kerapatan nomor piridina. Batang galat menunjukkan galat statistik dari kecocokan eksponensial profil kinetik, yang sesuai dengan dua deviasi standar (2 σ ).
Koefisien laju orde kedua diukur dengan mengulang prosedur ini pada kerapatan nomor Pyr yang berbeda . Seluruh prosedur telah dijelaskan dengan cermat dalam publikasi terbaru. [ 19 ] Panel kanan (b, d, dan f) menunjukkan laju orde pertama semu sebagai fungsi kerapatan nomor Pyr , yang dianalisis menggunakan regresi linier. Kemiringan garis yang disesuaikan menunjukkan koefisien laju orde kedua, yang dirangkum dalam Tabel 1 .
Tabel 1. Koefisien laju reaksi orde kedua
Bahasa Indonesia:
dengan Pyr . Nilai yang diperoleh dalam penelitian ini dibandingkan dengan nilai yang diperoleh oleh Pozniak dan Dunbar (lihat ref. 10 ).
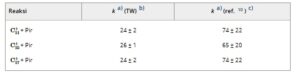
a) Koefisien laju orde kedua dalam 10 −10 cm 3 s −1
b) Pekerjaan ini: ketidakpastian yang diberikan adalah kesalahan relatif, dihitung sebagai ±2 σ . Kami memperkirakan kesalahan absolut sekitar 50%.
c) Ketidakpastian absolut berada dalam faktor 2.
Ketidakpastian relatif dapat diperkirakan dari kesalahan statistik dari kecocokan eksponensial dengan profil kinetik, yang sesuai dengan dua kali deviasi standar (2 σ ). Hal ini menghasilkan kesalahan relatif di bawah 10%. Namun, kesalahan absolut jauh lebih besar, terutama karena ketidakpastian dalam kerapatan nomor Pyr , yang memberikan kontribusi ketidakpastian sekitar 50%. Oleh karena itu, koefisien laju orde kedua untuk semua reaksi yang dipelajari konsisten dalam ketidakpastian ini dengan karya Pozniak dan Dunbar sebelumnya [ 10 ] (lihat Tabel 1 ). Selain itu, tren relatif dalam kedua penelitian tersebut serupa, dengan laju reaksi untuk gugus karbon yang hampir identik.
3.3 Reaktivitas Ion-Molekul yang Dipilih Isomer
Tidak seperti gugus karbon yang lebih kecil, beberapa gugus karbon stabil
struktur hidup berdampingan. ATD yang sesuai dengan m/z = 480 ditunjukkan sebagai garis hitam di Panel a Gambar 4 , yang memperlihatkan tiga keluarga isomer yang berbeda. Berdasarkan tren yang diamati dalam plot kontur karbon murni pada Gambar 2 dan wawasan dari penelitian sebelumnya, [ 3 , 16 ] keluarga-keluarga ini dapat dikaitkan dengan monoring, biring, dan fullerene. Fullerene, yang merupakan struktur paling padat, menunjukkan waktu kedatangan tercepat. Sebaliknya, struktur siklik muncul pada waktu kedatangan yang lebih lambat, dengan monoring menjadi yang paling lambat di antara semuanya. Metode yang dijelaskan dalam artikel ini digunakan untuk memilih setiap isomer dan mengungkapkan reaktivitasnya dengan Pyr .
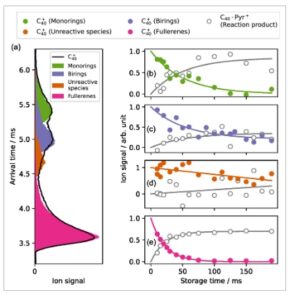
Gambar 4
Buka di penampil gambar
Panel (a): ATD dari
tanpa gerbang ion (garis hitam) dan menggunakan gerbang ion untuk memilih satu isomer (area berwarna hijau, ungu, jingga, dan merah muda). Panel (b, c, d, dan e): Profil kinetik reaksi antara isomer yang dipilih dan Pyr . Titik abu-abu sesuai dengan tampilan produk reaksi, sedangkan titik dan garis berwarna menunjukkan penipisan sinyal induk (data eksperimen dan data yang disesuaikan).
Area berwarna di Panel a menunjukkan distribusi saat gerbang ion listrik digunakan untuk memilih hanya satu isomer. Hilangnya struktur yang dipilih kemudian dilacak sebagai fungsi waktu penyimpanan, serta pembentukan C40 − Pyr + . Panel b, c, dan e dari Gambar 4 menunjukkan profil kinetik reaksi untuk monoring, biring, dan fullerene, masing-masing, pada kerapatan nomor Pyr 4 × 10 10 cm −3 . Satu-satunya saluran reaksi signifikan dengan setiap isomer adalah penambahan tunggal molekul Pyr . Tidak seperti reaksi dengan isomer lain, reaksi dengan spesies biring (Panel c) mencapai titik puncak dan tidak pernah mencapai konversi lengkap ion induk menjadi ion produk, yang menunjukkan adanya dua populasi berbeda dengan satu menjadi spesies yang tidak reaktif atau bereaksi sangat lambat. Populasi struktur yang hampir tidak reaktif ini diidentifikasi pada bagian tercepat dari ATD yang sedang berkembang, seperti yang ditunjukkan oleh ATD yang diberi label “Spesies yang tidak reaktif” pada Gambar 4 (dan juga pada Informasi Pendukung), Panel a, dan profil kinetik yang sesuai dari reaksinya dengan Pyr (Panel d). Oleh karena itu, spesies ini dapat berupa cincin bisiklik atau trisiklik yang kompak. Untuk memperhitungkan keberadaan mereka dalam populasi yang sedang berkembang (jejak biru), profil kinetik telah disesuaikan menggunakan peluruhan monoeksponensial untuk spesies reaktif, bersama dengan latar belakang yang konstan untuk memperhitungkan spesies yang tidak reaktif.
Hasil ini menunjukkan bahwa setiap isomer bereaksi secara berbeda dengan Pyr . Spesies fullerene bereaksi paling cepat, dan spesies biring bereaksi paling lambat. Pengamatan ini dikonfirmasi secara jelas oleh pengukuran konstanta laju orde kedua yang disajikan pada Gambar 5. Mereka menunjukkan bahwa isomer fullerene dari
menunjukkan laju reaksi yang jauh lebih tinggi daripada spesies cincin. Reaksi antara
cincin monosiklik dan Pyr juga dua kali lebih cepat dari reaksi spesies biring.
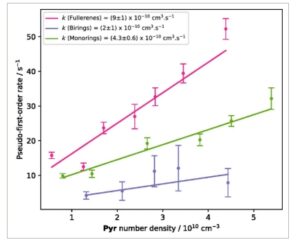
Gambar 5
Buka di penampil gambar
Laju orde semu-pertama sebagai fungsi kerapatan nomor Pyr untuk fullerene (merah), cincin bir (biru), dan cincin mono (hijau). Data disesuaikan dengan tren linier. Batang kesalahan dan ketidakpastian menunjukkan kesalahan statistik dari penyesuaian eksponensial profil kinetik (2 σ ).
4 Kesimpulan
Kami menyajikan kemampuan instrumen baru yang menggabungkan sumber penguapan laser dengan mobilitas ion dan spektrometri massa. Secara khusus, kami menunjukkan kemampuannya untuk melakukan reaksi ion-molekul yang dipilih secara isomer dan memperoleh koefisien laju, yang diilustrasikan melalui contoh reaksi antara berbagai gugus karbon kationik dan piridina.
Kami menilai metode kami menggunakan reaksi monoring karbon kecil, yang hanya memiliki satu isomer. Pengukuran koefisien laju orde kedua dilakukan untuk reaksi tiga gugus karbon.
Bahasa Indonesia:
dengan piridina. Hasil kami konsisten dengan temuan Pozniak dan Dunbar. [ 10 ]
Reaksi antara
dan piridina dianalisis secara rinci. Kami menunjukkan kemampuan kami untuk melakukan studi ion-molekul yang dipilih berdasarkan isomer dan memberikan koefisien laju orde kedua untuk setiap isomer. Oleh karena itu, metode ini dapat digunakan untuk mengkarakterisasi reaktivitas isomer yang hidup berdampingan, yang sangat berharga untuk gugus atom besar, misalnya.

