
Abstrak Grafis
Azobenzena beranggota sepuluh disintesis melalui reduksi elektrokimia 1,2-bis(2-nitrofenoksi)etana di bawah CO 2 . Azobenzena beranggota sepuluh mencapai 97% isomerisasi trans-ke-cis di bawah cahaya hijau (500 nm), dengan kedua isomer menunjukkan stabilitas termal dan foto yang luar biasa, tidak menunjukkan kelelahan selama beberapa siklus. Kombinasi sintesis yang mudah dan sifat fotofisika yang luar biasa menjadikan azobenzena beranggota sepuluh kandidat yang menjanjikan untuk aplikasi dalam sistem biologis.
Abstrak
Azobenzena siklik umumnya menunjukkan sifat fotofisika yang ditingkatkan dibandingkan dengan azobenzena linier konvensional, seperti aktivasi cahaya tampak dan stabilitas termal yang luar biasa. Namun, aplikasinya yang lebih luas telah terhalang oleh tantangan sintetis. Di sini, sintesis elektrokimia dari azobenzena siklik beranggota sepuluh, 6,7-dihidrodibenzo[e,i][1,4,7,8]dioksadiazesin (DDEI), dilaporkan melalui reduksi 1,2-bis(2-nitrofenoksi)etana (BNPOE) dengan adanya CO 2 . Mekanisme reduksi, yang melibatkan proses delapan elektron ireversibel dan penangkapan CO 2 , dijelaskan menggunakan spektroelektrokimia inframerah transformasi fourier in situ (FT-IR), dilengkapi dengan analisis 13 C NMR, 1 H NMR, dan spektrometri massa. Baik hasil eksperimen maupun perhitungan teori fungsi kerapatan menunjukkan bahwa DDEI mengalami isomerisasi trans -ke- cis yang sangat efisien di bawah penyinaran lampu hijau (500 nm), menghasilkan hasil yang luar biasa sebesar 97%, dengan kedua isomer menunjukkan stabilitas termal yang sangat baik. Berbeda dengan azobenzena siklik beranggota 8 dan 9 dan sejalan dengan azobenzena linier konvensional, konfigurasi trans DDEI lebih stabil daripada konfigurasi cis . Kombinasi aksesibilitas sintetis dan sifat fotofisika yang unggul ini menjadikan DDEI kandidat yang menjanjikan untuk berbagai aplikasi, termasuk dalam sistem kehidupan.
1 Pendahuluan
Azobenzena (Ph NN Ph) dikenal karena hadir dalam dua konfigurasi berbeda: bentuk trans yang memanjang dan bentuk cis yang bengkok . Kedua konformasi ini dapat saling bertukar secara reversibel di bawah penyinaran cahaya monokromatik, menjadikan azobenzena salah satu photoswitch molekuler yang paling banyak digunakan dalam bidang-bidang seperti fotofarmakologi [ 1 – 3 ] dan ilmu material. [ 4 – 8 ] Biasanya, konfigurasi trans yang stabil secara termodinamika mengalami fotoisomerisasi ke bentuk cis setelah penyinaran cahaya ultraviolet (UV), sedangkan isomer cis kembali ke bentuk trans melalui penyinaran cahaya tampak (>400 nm) atau relaksasi termal. [ 9 ] Namun, penggunaan cahaya UV menimbulkan tantangan signifikan dalam aplikasi biologis karena potensinya untuk menginduksi apoptosis. Lebih jauh, relaksasi termal tidak diinginkan untuk aplikasi dalam penyimpanan data, di mana sakelar yang digerakkan oleh cahaya dan stabil secara termal sangat dicari. [ 10 ]
Untuk mengatasi keterbatasan ini, satu strategi penting untuk meningkatkan sifat fotofisika azobenzena melibatkan pergeseran merah panjang gelombang aktivasinya dan meningkatkan stabilitas termalnya. Azobenzena siklik, di mana cincin benzenoid azobenzena dihubungkan oleh jembatan karbon atau heteroatom, telah muncul sebagai pendekatan yang menjanjikan untuk mencapai tujuan ini. [ 11 – 14 ] Misalnya, kelompok Herges melaporkan azobenzena cincin beranggota delapan yang menggabungkan heteroatom, yang menunjukkan panjang gelombang eksitasi yang meluas ke wilayah inframerah dekat. [ 12 , 14 , 15 ] Azobenzena siklik beranggota sembilan yang disintesis oleh Maier et al. diisomerisasi cis – trans reversibel di bawah fotoeksitasi 400 dan 520 nm, dan cis -isomernya menunjukkan stabilitas termal yang sangat baik. [ 16 ] Baru-baru ini, kelompok Staubitz [ 17 ] melaporkan beberapa azobenzena siklik beranggota 12. Berbeda dengan turunan azobenzena siklik beranggota 8, konfigurasi trans berada dalam keadaan stabil. Di antara mereka, satu contoh menunjukkan bahwa ia dapat secara selektif beralih ke isomer cis (81%, 365 nm) dan isomer trans (88%, 405 nm). Tidak ada relaksasi termal selama 120 hari pada suhu 25 °C, dan waktu paruh termal (beralih dari cis ke trans ) sangat panjang, yang dapat berguna untuk aplikasi seperti penyimpanan data dan material pintar. Meskipun azobenzena siklik memiliki sifat yang lebih unggul daripada azobenzena linier tradisional, aplikasinya yang lebih luas masih dibatasi oleh kurangnya metode sintetis yang efisien. Selain itu, contoh azobenzena siklik yang lebih besar masih jarang. [ 9 , 10 , 18 – 20 ]
Reduksi elektrokimia senyawa nitro aromatik menjadi turunan azo telah memperoleh perhatian besar sebagai pendekatan yang efisien dan ramah lingkungan. [ 21 – 23 ] Metode ini menggunakan elektron sebagai agen pereduksi, tidak memerlukan katalis, dan beroperasi dalam kondisi ringan dan terkendali dengan prosedur yang mudah. [ 24 – 27 ] Dalam beberapa tahun terakhir, kelompok kami telah berhasil mensintesis secara elektrokimia beberapa turunan azobenzena, seperti 4,4′-dinitrosoazobenzena, [ 21 ] 11,12-dihidrodibenzo[c,g][1,2]diazosin, [ 28 ] dan benzo[c]sinolina, [ 23 ] dengan mereduksi senyawa nitro aromatik dengan adanya CO 2 . Pendekatan ini menawarkan keuntungan penting dibandingkan metode sintesis organik tradisional, khususnya dalam produksi azobenzena siklik, karena efisiensinya yang tinggi dan aksesibilitasnya. [ 14 , 28 ] Selain itu, produk ini ramah lingkungan karena secara bersamaan mengurangi polutan lingkungan (senyawa nitro) dan menangkap gas rumah kaca (CO 2 ).
Dalam studi ini, kami melaporkan sintesis elektrokimia dari azobenzena siklik beranggota sepuluh, 6,7-dihidrodibenzo[e,i][1,4,7,8]dioksadiazesin (DDEI), menggunakan 1,2-bis(2-nitrofenoksi)etana (BNPOE) sebagai prekursor dengan adanya CO 2 . Proses reduksi BNPOE diselidiki dengan spektroelektrokimia inframerah transformasi Fourier in situ (FT-IR), 13 C NMR, 1 H NMR, dan spektrometri massa (MS). Mekanisme reduksi terperinci dari BNPOE ke DDEI diusulkan, yang merupakan proses transfer 8 elektron yang kompleks. Analisis fotofisika, termasuk spektroskopi UV–vis dan perhitungan teoritis, mengungkapkan bahwa konfigurasi trans DDEI disukai secara termodinamika dan baik isomer trans maupun cis sangat peka terhadap cahaya namun stabil secara termal.
2 Hasil dan Pembahasan
2.1 Perilaku Elektronik BNPOE dalam Larutan Asetonitril Terisi CO2
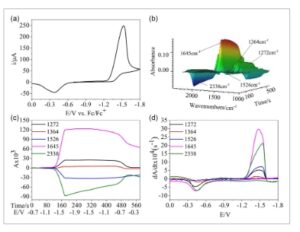
Gambar 1a menunjukkan kurva voltamogram siklik (CV) dari 10 mM BNPOE dalam larutan asetonitril (AN) yang jenuh dengan CO 2 . Rentang pemindaian potensial CV dari -0,7 hingga -1,8 V dan kembali ke 0,0 V. Puncak reduksi tunggal pada -1,53 V diamati dalam rentang potensial -0,7–-1,8 V. Pada sapuan terbalik (dari -1,8 kembali ke 0,0 V), puncak oksidasi yang lebih kecil pada -0,37 V terdeteksi, yang menunjukkan bahwa reaksinya ireversibel. Gambar 1b menyajikan spektrum inframerah 3D yang sesuai dalam rentang 1000–2500 cm -1 , di mana puncak ke atas mewakili pembentukan spesies baru, dan puncak ke bawah menunjukkan hilangnya spesies. BNPOE menunjukkan lima puncak penyerapan karakteristik selama proses elektrokimia: dua puncak ke bawah pada 1526 dan 2338 cm −1, dan tiga puncak ke atas pada 1272, 1364, dan 1645 cm −1 .
Gambar 1
Buka di penampil gambar
Kekuatan Gambar
a) CV dari 10 mM BNPOE dalam larutan asetonitril (AN) dengan 0,2 M TEABF 4 di bawah CO 2 (sel lapisan tipis; laju sapuan: 5 mV s −1 ). b) Spektrum 3D yang sesuai dari FT-IR in situ. c) CVA dan d) DCVA pada 1272, 1364, 1526, 1645, dan 2338 cm −1 . Data DCVA dari 1526 dan 2338 cm −1 dikalikan dengan −1 untuk perbandingan dengan CV.
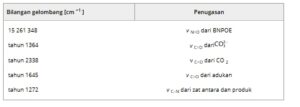
Puncak pada 1526 cm −1 berhubungan dengan vibrasi peregangan asimetris dari gugus NO 2 dalam BNPOE dan digunakan untuk memantau perubahan konsentrasi reaktan. [ 23 ] Puncak pada 2338 cm −1 dikaitkan dengan vibrasi peregangan CO dari CO 2 , yang melacak perubahan konsentrasi CO 2 . [ 29 , 30 ] Puncak pada 1272 cm −1 dikaitkan dengan vibrasi peregangan C N pada produk antara dan produk akhir, [ 31 ] sedangkan puncak pada 1364 cm −1 dikaitkan dengan vibrasi peregangan CO dari ion karbonat (mathematical equation), menunjukkan pembentukan karbonat selama proses reduksi elektrokimia. [ 32 ] Puncak pada 1645 cm −1 sesuai dengan getaran peregangan CO dari adukan CO 2 dan digunakan untuk memantau perubahan konsentrasi adukan selama proses reduksi. [ 33 ] Tabel 1 merangkum penugasan setiap puncak serapan inframerah untuk BNPOE selama proses elektrokimia.
Tabel 1. Atribusi puncak serapan inframerah dalam reduksi elektrokimia.
Untuk menyelidiki lebih lanjut proses reaksi elektrokimia BNPOE dengan adanya CO 2 , spektrum 3D diproses untuk memperoleh diagram voltabsorptometri siklik (CVA, Gambar 1c ) dan voltabsorptometri siklik turunan (DCVA, Gambar 1d ). Seperti yang ditampilkan dalam Gambar 1c , puncak serapan pada 1526 dan 2338 cm −1 menurun secara bertahap, sedangkan puncak serapan pada 1272, 1364, dan 1645 cm −1 meningkat pada awalnya dan kemudian stabil. Secara khusus, puncak serapan pada 1526 cm −1 mulai menurun secara bertahap dan mencapai minimumnya pada 180 detik (−1,6 V), setelah itu tetap konstan tanpa kembali ke nilai absorbansi awalnya. Ini menunjukkan bahwa reaksi BNPOE lengkap dan ireversibel. Demikian pula, puncak penyerapan pada 2338 cm −1 mulai menurun pada 120 detik dan mencapai minimumnya pada ≈180 detik, yang menunjukkan bahwa CO2 bereaksi dengan BNPOE.
Selain itu, puncak serapan pada 1645 cm −1 mulai naik sedikit lebih awal daripada puncak pada 1364 cm −1 . Pengamatan ini menunjukkan bahwa BNPOE awalnya membentuk aduk dengan CO 2 , yang kemudian mengembun untuk menghilangkanmathematical equationKurva DCVA menguatkan hasil CV, memberikan bukti lebih lanjut tentang jalur reaksi. Singkatnya, reaksi elektrokimia BNPOE dengan adanya CO 2 merupakan proses kompleks dan bertahap yang melibatkan banyak elektron.
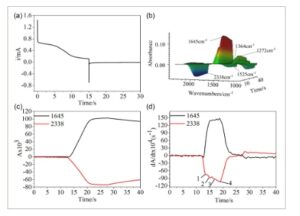
Untuk lebih jauh menjelaskan mekanisme reduksi reaksi reduksi elektrokimia kompleks antara CO 2 dan BNPOE, percobaan gabungan dari teknik langkah potensial ganda dan spektroskopi inframerah beresolusi waktu pemindaian cepat dilakukan. Lima puncak serapan karakteristik pada 1272, 1364, 1526, 1645, dan 2338 cm −1 diamati dalam gambar inframerah 3D. Puncak serapan karakteristik CO 2 (2338 cm −1 ) dan puncak karakteristik aduk yang terbentuk antara reaktan dan CO 2 (1645 cm −1 ) dipilih untuk analisis terperinci. Data yang sesuai diproses untuk menghasilkan diagram kronoamperometri absorptiometri (CAA) ( Gambar 2c ) dan CAA turunan (DCAA) ( Gambar 2d ). Kurva DCAA pada 2338 cm −1 menunjukkan empat puncak berbeda, yang menunjukkan bahwa CO 2 berpartisipasi dalam reaksi empat langkah selama proses reduksi elektrokimia BNPOE.
Gambar 2
Buka di penampil gambar
Kekuatan Gambar
a) Kurva CA kumpulan lapisan tipis BNPOE 10 mM dalam larutan AN yang mengandung CO 2 . b) Potensi langkah dua potensial adalah (−0,7 ≈ −1,8 ≈ −0,7 V) dan plot spektrum IR 3D yang sesuai, c) Plot CAA dan d) DCAA dari BNPOE pada 1645 dan 2338 cm −1 .
Untuk menentukan jumlah total elektron yang ditransfer selama reaksi elektrokimia BNPOE, integrasi koulometri puncak reduksi pada kurva CV BNPOE dan 2,6-diklorobenzoquinone (2,6-DCBQ) dilakukan (Gambar S1, Informasi Pendukung). Dalam konteks ini, 2,6-DCBQ digunakan sebagai referensi standar, karena proses elektrokimianya melibatkan transfer dua elektron dalam larutan asetonitril yang jenuh dengan CO 2 . [ 34 ] Dengan menggunakan Persamaan Faraday ( 1 ), jumlah total elektron yang ditransfer untuk jumlah molar ekivalen BNPOE dalam kondisi CO 2 dihitung menjadi ≈8. Hasil terperinci dirangkum dalam Tabel S1, Informasi Pendukung.
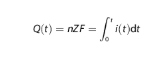
dimana Q adalah besaran listrik (C), n adalah jumlah mol zat yang bereaksi (mol), Z adalah jumlah perpindahan elektron pada proses reaksi elektrokimia, F adalah konstanta Faraday (96.500 C mol −1 ), i adalah kuat arus (A) dan t adalah waktu reaksi (s).
2.2 Sintesis Elektrokimia DDEI
Untuk lebih memvalidasi mekanisme reduksi, elektrolisis BNPOE dilakukan. Berdasarkan kurva voltametri sapuan linier (LSV) (Gambar S2, Informasi Pendukung), potensi elektrolisis ditetapkan pada −2,1 V. Selama proses elektrolisis, sebagian kecil elektrolit diekstraksi secara berkala untuk kromatografi lapis tipis guna memantau kemajuan reaksi.
BNPOE diubah menjadi produk antara dan akhirnya menjadi produk akhir, senyawa azobenzena siklik beranggota sepuluh (DDEI), masing-masing setelah 12 dan 48 jam. Struktur produk antara dan produk akhir dikonfirmasi melalui resonansi magnetik nuklir dan analisis MS (Gambar S4, S5, S8, dan S9, Informasi Pendukung). Hasil DDEI ditentukan sebesar 74%. Karena data yang dikumpulkan selama tiga jam pertama dapat menilai efisiensi elektrolisis secara akurat, [ 23 , 28 ] kurva lgi( t ) versus t diplot untuk periode 3 jam awal (Gambar S3, Informasi Pendukung). Dengan menggunakan Rumus ( 2 ) dan ( 3 ), efisiensi elektrolisis yang sangat tinggi sebesar 95% tercapai.
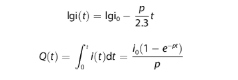
di mana i ( t ) adalah arus elektrolit (A); i 0 adalah arus awal (A); p = m 0 A / V , m 0 adalah koefisien perpindahan massa (cm s −1 ), A adalah luas elektroda (cm 2 ), dan V adalah volume total larutan (cm 3 ); Q ( t ) adalah jumlah listrik (C); t adalah waktu reaksi (s).
Untuk menilai tingkat konversi BNPOE menjadi DDEI, larutan elektrolit (dengan elektrolit pendukung dihilangkan) dianalisis menggunakan kromatografi cair kinerja tinggi (Gambar S7, Informasi Pendukung). Analisis mengungkapkan bahwa hanya sejumlah kecil BNPOE yang tersisa dalam larutan elektrolisis, yang menunjukkan tingkat konversi tinggi sebesar 94%.
2.3 Mekanisme Reduksi Elektrokimia BNPOE menjadi DDEI
Berdasarkan analisis yang disebutkan di atas, mekanisme reduksi elektrokimia terperinci dari BNPOE dalam kehadiran karbon dioksida diusulkan (Skema 1 ). Awalnya, BNPOE ( 1 ) mengalami reduksi elektron tunggal untuk membentuk anion radikal BNPOE •− ( 2 ), yang bereaksi cepat dengan CO 2 untuk menghasilkan aduk yang sesuai ( 3 ). Selanjutnya, senyawa 3 memperoleh elektron lain dan secara bersamaan menghilangkan ion karbonat (mathematical equation), yang mengarah pada pembentukan senyawa nitroso ( 4 ). Senyawa nitroso kemudian mengalami reaksi lebih lanjut melalui proses yang sama, yang akhirnya menghasilkan siklisasi intramolekuler untuk membentuk senyawa ( 7 ). Mengikuti langkah-langkah reaksi yang analog, senyawa 7 diubah menjadi produk antara ( 10 ). Akhirnya, produk target, senyawa azobenzena beranggota sepuluh ( 11 ), diperoleh melalui penyerapan dua elektron tambahan dan satu molekul karbon dioksida, disertai dengan eliminasi ion karbonat (mathematical equation).
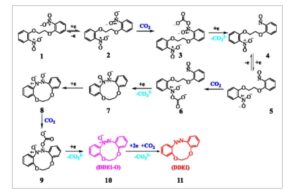
Skema 1
Buka di penampil gambar
Kekuatan Gambar
Mekanisme reduksi elektrokimia BNPOE menjadi DDEI.
2.4 Properti Photoswitch DDEI
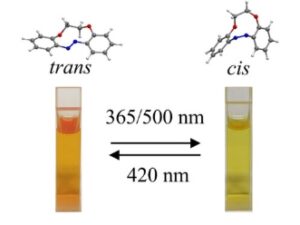
Seperti yang ditunjukkan pada Gambar 3a , DDEI yang disintesis secara elektrokimia menunjukkan perilaku photoswitching yang berbeda, yang memungkinkan isomerisasi reversibel antara dua konfigurasi di bawah panjang gelombang cahaya yang berbeda. Secara khusus, larutan DDEI berwarna jingga pada keadaan awalnya dan bertransisi ke keadaan fotostasioner (PSS) hijau kekuningan setelah disinari dengan cahaya 365 atau 500 nm. Saat terkena cahaya 420 nm, PSS kembali ke konfigurasi aslinya.
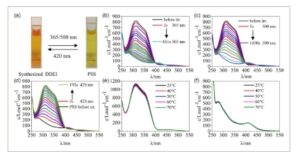
Gambar 3
Buka di penampil gambar
Kekuatan Gambar
Larutan DDEI hasil sintesis elektrokimia sebelum dan setelah penyinaran. Spektrum UV-tampak DDEI sebelum dan setelah penyinaran setelah penyinaran hingga 365 nm, b) dan 500 nm, c). d) Spektrum UV-tampak PSS sebelum dan setelah penyinaran setelah penyinaran hingga 420 nm. Spektrum UV-tampak DDEI hasil sintesis, e) dan PSS setelah penyinaran 365 nm, f) pada suhu yang berbeda selama 5 menit.
Reaksi isomerisasi dipantau menggunakan spektroskopi UV-vis. Seperti yang digambarkan pada Gambar 3b , DDEI yang disintesis awalnya menunjukkan puncak serapan pada 310 nm dan puncak bahu pada 350 nm (garis hitam). Setelah disinari dengan cahaya 365 nm, puncak serapan ini secara bertahap menurun dan stabil, membentuk spektrum dengan puncak pada 275 dan 420 nm dalam 161 detik, yang menunjukkan isomerisasi yang berhasil. Demikian pula, penyinaran dengan cahaya 500 nm juga menginduksi isomerisasi, meskipun durasi yang lebih lama yaitu 1450 detik diperlukan untuk mencapai PSS (Gambar 3c ). Seperti yang ditunjukkan pada Gambar 3d , PSS secara bertahap kembali ke konfigurasi asli dalam 193 detik saat terpapar cahaya 420 nm.
Untuk menganalisis lebih lanjut kinerja fotokromik, spektroskopi NMR 1H (Gambar S10, Informasi Pendukung) dan integrasi sinyal karakteristik (Gambar S11–S13, Informasi Pendukung) digunakan. Hasilnya menunjukkan bahwa DDEI yang disintesis mencapai hasil PSS sebesar 93% dan 97% di bawah cahaya 365 dan 500 nm, yang menunjukkan bahwa baik sinar UV maupun sinar tampak dapat secara efektif mendorong isomerisasi, dengan sinar tampak menunjukkan efisiensi yang sangat tinggi. Selain itu, isomerisasi terbalik di bawah cahaya 420 nm mencapai hasil sebesar 85%, yang selanjutnya mengonfirmasi sifat reversibel dari proses tersebut.
Untuk menyelidiki stabilitas termal dari dua isomer, larutan DDEI yang disintesis (Gambar 3e dan PSS setelah iradiasi 365 nm (Gambar 3f ) dipanaskan dalam penangas air pada berbagai suhu (25, 40, 50, 60, dan 70 °C) selama 5 menit dan selanjutnya dianalisis menggunakan spektroskopi UV–vis. Puncak serapan karakteristik dari konfigurasi asli menunjukkan sedikit penurunan saat suhu meningkat hingga 70 °C, sedangkan puncak serapan PSS hampir tidak berubah. Hasil ini menunjukkan bahwa kedua isomer DDEI memiliki stabilitas termal yang sangat baik, dan interkonversinya sebagian besar diatur oleh cahaya daripada efek termal.
2.5 Mekanisme Photoswitch DDEI
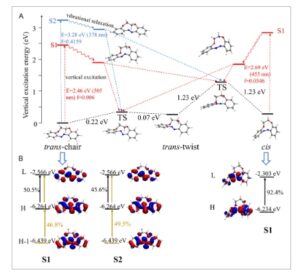
Untuk menjelaskan mekanisme photoswitch dari DDEI, isomer trans dan cis dioptimalkan menggunakan metode teori fungsi kerapatan (DFT). Tidak seperti azobenzena siklik beranggota 8 dan 9, [ 11 , 14 , 16 , 35 ] tetapi konsisten dengan azobenzena linier konvensional, [ 36 – 38 ] konfigurasi trans DDEI lebih stabil daripada konfigurasi cis . Isomer trans terdiri dari dua konformasi yang berbeda: chair dan twist. Konformasi trans -twist memiliki energi 3,46 kkal mol −1 lebih tinggi daripada konformasi trans -chair, sedangkan isomer cis memiliki energi 3,48 kkal mol −1 lebih tinggi daripada konformasi trans -twist.
Seperti yang ditunjukkan pada Gambar 4a , penghalang energi untuk konversi termal dari konformasi trans -twist ke trans -chair minimal, hanya 0,07 eV (1,61 kcal mol −1 ), yang menunjukkan bahwa konsentrasi konformasi twist pada kesetimbangan dapat diabaikan. Akibatnya, dua konfigurasi yang diamati dalam eksperimen photoswitch dapat diidentifikasi sebagai isomer trans -chair dan cis . Spektrum UV–vis sebelum dan sesudah iradiasi terutama mencerminkan eksitasi isomer trans -chair dan cis , masing-masing.
Gambar 4
Buka di penampil gambar
Kekuatan Gambar
a) Diagram energi relatif dari keadaan dasar dan keadaan tereksitasi. Struktur isomer trans (kursi dan lilitan) dan cis serta TS yang sesuai. b) Kontribusi orbital molekul yang terkait dengan transisi S0 → S1 dan S0 → S2 untuk konfigurasi trans -kursi, dan transisi S0 → S1 untuk konfigurasi cis (isosurface = 0,04).
Perhitungan DFT bergantung waktu (TD-DFT) dari isomer kursi dan cis menghasilkan spektrum (Gambar S14, Informasi Pendukung) yang selaras dengan data eksperimen. Energi eksitasi yang dihitung relatif terhadap panjang gelombang eksperimen diilustrasikan dalam Gambar 4a . Untuk konfigurasi trans -kursi, transisi S0 → S1 dan S0 → S2 terjadi pada 2,46 eV (505 nm) dan 3,28 eV (378 nm), yang sesuai dengan panjang gelombang photoswitch eksperimental masing-masing 500 dan 365 nm. Untuk konfigurasi cis , transisi S0 → S1 terjadi pada 2,69 eV (455 nm), yang selaras dengan panjang gelombang eksitasi eksperimental 420 nm.
Setelah terpapar cahaya eksitasi, eksitasi vertikal diikuti oleh relaksasi vibrasi, yang mengarah ke keadaan dasar dari keadaan tereksitasi. Karena struktur relaksasi ini secara signifikan lebih tinggi energinya daripada keadaan transisi (TS), struktur ini diharapkan berubah menjadi TS dan selanjutnya kembali ke keadaan dasar S0 dari konfigurasi kursi atau cis . Dengan penyinaran cahaya berkelanjutan, reaksi isomerisasi selesai, menunjukkan perilaku photoswitching reversibel DDEI.
Seperti yang ditunjukkan pada Gambar 4b , transisi S0 → S1 dan S0 → S2 dari isomer kursi terutama diatur oleh interaksi orbital antara orbital molekul tak terisi terendah (LUMO) dan orbital molekul terisi tertinggi (HOMO) serta HOMO-1. Baik HOMO maupun HOMO-1 adalah orbital π, sedangkan LUMO adalah orbital π*, yang menunjukkan bahwa transisi dalam konfigurasi kursi bersifat π–π*. Demikian pula, konfigurasi cis juga menunjukkan transisi π–π*, sebagaimana dibuktikan oleh kontribusi dominan (92,4%) dari HOMO ke LUMO dalam isomer ini.
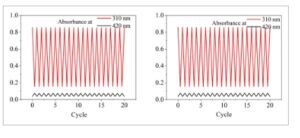
Senyawa yang digunakan sebagai photoswitch harus menunjukkan kelelahan fotokimia yang rendah untuk memungkinkan sejumlah besar siklus switching. Untuk mengevaluasi sifat photoswitching DDEI, senyawa tersebut diiradiasi secara bergantian dengan cahaya 365 dan 420 nm. Seperti yang ditunjukkan pada Gambar 5 , tidak ada tanda-tanda fotodegradasi yang diamati, yang menunjukkan fotostabilitas DDEI yang luar biasa.
Gambar 5
Buka di penampil gambar
Kekuatan Gambar
Kiri: absorbansi larutan DDEI pada 310 nm (merah) setelah penyinaran dengan cahaya 420 nm, dan absorbansi pada 420 nm (hitam) setelah penyinaran dengan cahaya 365 nm. Kanan: absorbansi DDEI pada 310 nm setelah penyinaran dengan cahaya 420 nm, dan absorbansi pada 420 nm setelah penyinaran dengan cahaya 500 nm.
3 Kesimpulan
Singkatnya, azobenzena beranggota sepuluh, DDEI, berhasil disintesis melalui reduksi elektrokimia senyawa nitro aromatik BNPOE dengan adanya CO 2 . Proses ini menghasilkan rendemen tinggi sebesar 74%, efisiensi elektrolisis sebesar 95%, dan laju konversi sebesar 94%. Kombinasi teknik eksperimen, termasuk spektroelektrokimia FT-IR in situ, 13 C NMR, 1 H NMR, dan MS, mengungkapkan bahwa BNPOE mengalami proses 8-elektron ireversibel, yang memfasilitasi siklisasi intramolekuler dan akhirnya membentuk DDEI.
DDEI menunjukkan kinerja fotokromik yang luar biasa, yang memungkinkan isomerisasi efektif setelah penyinaran dengan cahaya 365 atau 500 nm, dan konversi reversibel di bawah cahaya 420 nm, dengan hasil yang tinggi. Perhitungan DFT menunjukkan bahwa konfigurasi trans -twist secara energetik lebih disukai daripada bentuk cis , yang selaras dengan azobenzena konvensional tetapi kontras dengan azobenzena siklik beranggota 8 dan 9. Spektrum UV-vis yang dihitung konsisten dengan pengamatan eksperimental, yang mengonfirmasi transisi π–π* di kedua isomer. Selain itu, baik isomer trans maupun cis menunjukkan stabilitas termal dan fotostabilitas yang sangat baik, tidak menunjukkan tanda-tanda kelelahan di bawah paparan cahaya berulang.
Karya ini tidak hanya menetapkan pendekatan elektrokimia hijau untuk mensintesis azobenzena siklik besar tetapi juga menunjukkan potensi penangkapan CO2 selama proses berlangsung.

