
Abstrak
LATAR BELAKANG
Meningkatnya permintaan global untuk jamur berarti peningkatan produksi limbah jamur padat (SMW), yang membutuhkan pendekatan baru untuk valorisasi limbah. Batang limbah dan jamur yang bentuknya tidak beraturan kaya akan polimer kitin-glukan – sumber prebiotik yang menjanjikan. Tter16 (EC 3.2.1.6) dari Thielavia terrestris dikloning, diekspresikan secara rekombinan dalam Pichia pastoris , dan dikarakterisasi secara biokimia. Preparasi koktail enzim yang mengandung Tter16, dua endo-β-1,3(4)-glukanase lainnya (Csph16A dan Csph16A-ΔC) dan satu endo-β-1,6-glukanase (Tvir30) (EC 3.2.1.75), digunakan untuk mendegradasi fraksi glukan dari kitin-glukan jamur dengan tujuan untuk meningkatkan valorisasi polimer bioaktif dalam limbah jamur komersial.
HASIL
Tter16 aktif secara optimal pada pH 5,0, 50 °C, dan hipertermostabil pada 50 °C dengan nilai D 33 hari. Tm Tter16 ditetapkan sebesar 67,77 °C dan analisis spesifisitas substrat mengungkapkan preferensi untuk β-glukan ikatan campuran. Tter16 ditemukan memiliki salah satu angka pergantian tertinggi yang tercatat untuk glukanase jamur nonselulolitik, dengan nilai 1221 s −1 . Koktail enzim menghasilkan oligosakarida termasuk disakarida ikatan β-1,6 dan oligosakarida ikatan β-1,3 DP 2–5, sambil meminimalkan produksi glukosa pada >90 menit hidrolisis kitin-glukan. Sebuah studi hidrolisis kitin-glukan skala kecil menghasilkan rendemen gula larut sebanyak 242,5 mg per gram substrat (rendemen 24,3%) setelah 90 menit hidrolisis. Oligosakarida ini ditemukan dapat mendukung pertumbuhan probiotik Lacticaseibacillus rhamnosus (sebelumnya Lactobacillus rhamnosus ) secara in vitro .
KESIMPULAN
Sifat biokimia Tter16 sangat sesuai untuk aplikasi yang dimaksudkan untuk pemanfaatan limbah jamur. Hidrolisis enzimatik kitin-glukan melepaskan β-glukoligosakarida yang menunjukkan potensi prebiotik. Sejauh pengetahuan kami, ini adalah laporan pertama tentang degradasi enzimatik kooperatif kitin-glukan dengan tujuan membebaskan β-glukoligosakarida prebiotik dari limbah jamur padat dan pengujian aplikasi in vitro berikutnya . © 2025 Penulis. Jurnal Teknologi Kimia dan Bioteknologi diterbitkan oleh John Wiley & Sons Ltd atas nama Society of Chemical Industry (SCI).
SINGKATAN
DP
tingkat polimerisasi
Bahasa Inggris
glikosida hidrolase
GOS
gluko-oligosakarida
Pesan singkat
substrat jamur bekas
SMW
limbah jamur padat
PERKENALAN
Pasar jamur global telah mengalami pertumbuhan yang stabil selama tiga dekade terakhir, dengan produksi di seluruh dunia diperkirakan mencapai 20,84 juta ton pada tahun 2026, naik dari 12,74 juta ton pada tahun 2018. 1 , 2 Istilah ‘jamur’ mengacu pada tubuh buah basidiomycetes, dan lima spesies yang paling umum dibudidayakan adalah Lentinula (jamur shiitake), Pleurotus (jamur tiram), Auricularia (jamur insang), Agaricus (jamur kancing) dan Flammulina (jamur kaki beludru). 3 Meningkatnya permintaan jamur sebagian besar merupakan konsekuensi dari meningkatnya kesadaran konsumen akan kesehatan dan kebugaran, karena jamur adalah sumber makanan rendah kalori dan bergizi yang kaya akan serat dan protein (≈2% dari berat segar) dengan komposisi asam amino yang menguntungkan (terutama asam aspartat, asam glutamat dan arginin) dibandingkan dengan beberapa sayuran akar. Mereka juga menyediakan berbagai mineral dan vitamin, termasuk zat besi (Fe), magnesium (Mg) dan vitamin D2. 4 , 5 Bergantung pada spesiesnya, jamur dibudidayakan pada substrat lignoselulosa yang dipasteurisasi seperti jerami, tongkol jagung dan daun, atau pada kompos yang difermentasi. 6 Proses produksi komersial menghasilkan tiga aliran limbah utama: substrat jamur bekas (SMS), limbah jamur padat (SMW) dalam bentuk tangkai dan jamur yang bentuknya tidak beraturan, dan residu jamur pasca ekstraksi. 3 Penelitian signifikan telah difokuskan pada pemanfaatan SMS, yang biasanya diproduksi pada tingkat 5 kg per 1 kg jamur, untuk aplikasi seperti produksi bioetanol, produksi tanaman pangan dan suplementasi pakan ternak. 7 , 8
Untuk meningkatkan keberlanjutan proses produksi jamur, SMW harus dieksplorasi sebagai sumber senyawa bioaktif yang berharga. Meskipun SMW sebelumnya telah divalorisasi melalui pengobatan protease, aplikasi yang paling masuk akal adalah produksi biostimulan tanaman. 9 , 10 Namun, disregulasi mikrobioma usus merupakan masalah kesehatan global yang utama dan solusi baru diperlukan untuk menangani masalah ini, terutama karena komposisi mikrobioma sangat bervariasi dan pendekatan ‘satu ukuran untuk semua’ untuk menyembuhkan usus tidak realistis. 11 Margin keuntungan yang tinggi yang terkait dengan industri kesehatan dan kebugaran dibandingkan dengan, misalnya, industri pertanian, dapat memberi insentif kepada perusahaan untuk secara giat mendekati valorisasi SMW sebagai strategi bisnis yang layak, sehingga berkontribusi pada ekonomi sirkular.
Karbohidrat merupakan fraksi terbesar dari bahan kering jamur, menjadikan jamur sebagai sumber potensial yang menarik untuk prebiotik baru (atau yang sudah ada). Sekitar 53% (b/b) dari stipe dan tudung Agaricus bisporus , jamur komersial yang paling umum di dunia Barat, 7 tersusun dari karbohidrat. Mayoritas karbohidrat ini ada sebagai kompleks kitin-glukan di dalam dinding sel jamur. Dalam kompleks ini, β-glukan – polimer unit d -glukosa yang dihubungkan oleh ikatan β-1,3-glikosidik dengan titik cabang β-1,6 dan ikatan β-1,4 sesekali tergantung pada sumbernya – terikat secara kovalen pada kitin melalui ikatan β-1,4- dan β-1,6-. 12 – 14 Kitin, suatu polisakarida dari monomer N -asetilglukosamin, dan turunannya kitosan memiliki banyak aplikasi dalam bioremediasi, pengobatan, dan industri makanan dan minuman, menjadikan ekstraksinya dari SMW sangat bernilai, seperti yang telah didokumentasikan sebelumnya. 15 – 17
β-glukan jamur telah menunjukkan aktivitas prebiotik dan imunostimulan, meskipun aplikasi industrinya terhalang oleh viskositasnya yang tinggi akibat panjang polimer. 18 – 20 Prebiotik didefinisikan sebagai substrat yang digunakan secara selektif oleh mikroorganisme probiotik yang bermanfaat, sehingga memberikan manfaat kesehatan bagi inangnya. 21 Menurut tinjauan tahun 2020, glukooligosakarida (GOS), termasuk β-1,3-, β-1,6-, atau oligomer d -glukosil yang terhubung dengan β-1,3/1,4 dengan derajat polimerisasi (DP) rata-rata 2–10, diidentifikasi sebagai kandidat prebiotik. 22 Oleh karena itu, pemrosesan enzimatik β-glukan jamur dalam SMW merupakan sumber potensial produk bernilai tambah dalam bentuk GOS prebiotik sekaligus mengatasi masalah kelarutan dan kapasitas adsorpsi yang terkait dengan β-glukan utuh. Laporan sebelumnya tentang aktivitas prebiotik gluko-oligosakarida mencakup hidrolisis substrat yang sangat murni dan homogen oleh satu enzim atau kelas enzim. 23 – 26 Dalam penelitian saat ini, campuran enzim yang terdiri dari berbagai aktivitas enzim dibuat khusus untuk substrat yang sangat heterogen dan relatif melimpah; kitin-glukan jamur. Selain itu, perlakuan enzimatik lebih disukai daripada hidrolisis asam tradisional karena lebih ramah lingkungan, aman, dan berkelanjutan. Sejauh pengetahuan kami, ini adalah laporan pertama tentang konversi enzimatik gabungan kitin-glukan jamur yang tidak larut dalam alkali menggunakan β-glukanase untuk menghasilkan GOS dengan potensi prebiotik in vitro .
Dalam studi pembuktian konsep ini, glikosida hidrolase 16 (GH16) endo-β-1,3(4)-glukanase (Tter16, EC 3.2.1.6) yang berasal dari jamur toleran panas Thielavia terrestris diproduksi secara rekombinan di Pichia pastoris dan digunakan dalam kombinasi dengan dua endo-β-1,3(4)-glukanase yang telah dipublikasikan sebelumnya (Csph16A dan Csph16A-ΔC) 27 dan satu endo-β-1,6-glukanase (Tvir30, EC 3.2.1.75). 26 Koktail enzim yang telah disiapkan digunakan untuk mendegradasi fraksi glukan dari polimer kitin-glukan yang tidak larut dalam alkali menjadi GOS. Pilihan enzim mencerminkan komposisi substrat, yaitu polimer kitin-glukan yang tidak larut dalam alkali yang diisolasi dari dinding sel jamur. Polimer kompleks ini bervariasi antara spesies jamur dan juga pada berbagai tahap siklus hidup jamur. Namun, semua spesies memiliki konstituen yang sama: glukan dengan berbagai ikatan, termasuk β-1,3-, β-1,6-, β-1,3-/1,4-, dan kitin serta turunannya yang telah dideasetilasi, yaitu kitosan. Oleh karena itu, koktail enzimatik mengandung semua aktivitas hidrolitik yang diperlukan untuk memecah β-glukan dan membiarkan kitin tetap utuh. Lebih jauh lagi, glukanase yang dipilih berasal dari jamur yang awalnya diisolasi dari kompos jamur, yang dapat menunjukkan bahwa mereka memiliki peningkatan kapasitas untuk mendegradasi komponen jamur. Selain itu, asal usul termofilik Tter16 dapat bermanfaat dalam proses industri jika enzim tersebut menunjukkan termostabilitas.
EKSPERIMENTAL
Bahan
Semua materi relevan yang berkaitan dengan kloning, ekspresi, dan karakterisasi enzim tercantum dalam Klemanska et al . (2024). 27 Urutan gen Tter16 dioptimalkan kodon untuk ekspresi dalam Pichia pastoris dan disintesis oleh Eurofins Genomics (Ebersberg, Bavaria, Jerman). Kolom CarboPac PA200 dibeli dari Thermo Fisher Scientific (Waltham, MA, AS) dan dipasang pada instrumen Dionex ICS-5000 (Thermo Fisher Scientific) tanpa kolom pelindung. Komponen fase bergerak [larutan natrium hidroksida (NaOH) 1 mol L −1 dan natrium asetat trihidrat (NaOAc)] dibeli dari Lennox (Richardson, TX, AS). Standar HPAEC (glukosa, N- asetilglukosamin, gentiobiosa, dan laminarioligosakarida dengan DP 2-5) diperoleh dari Megazyme (Bray, County Wicklow, Irlandia) dan kitin-glukan yang berasal dari jamur dibeli dari Glentham Life Sciences (Corsham, Wiltshire, Inggris). Kitinase dari Trichoderma viride dibeli dari Sigma-Aldrich, Irlandia (Arklow, County Wicklow, Irlandia) dan enzim glukanase komersial diperoleh dari AB Enzymes (Darmstadt, Jerman).
Analisis in silico , produksi rekombinan, dan karakterisasi Tter16
Kloning, ekspresi dalam Pichia pastoris dan pemurnian kromatografi afinitas logam terimobilisasi (IMAC) selanjutnya dilakukan sesuai dengan Klemanska et al . (2024), seperti halnya analisis in silico , aktivitas glukanase dan uji konsentrasi protein, dan karakterisasi biokimia. 27 Penentuan konstanta kinetik dicapai dengan memantau laju hidrolisis substrat sebagai fungsi konsentrasi substrat dalam kondisi optimum enzim pada pH 5,0 dan 50 °C. Konsentrasi substrat berkisar dari 0,5 hingga 20 mg mL −1 . Plot konsentrasi substrat versus kecepatan enzim dipasang menggunakan regresi nonlinier dalam Prism 9.0 (GraphPad, San Diego, CA, AS), yang kemudian memperkirakan konstanta kinetik Km , V max dan k cat dari grafik ini.
MALDI-TOF MS/MS
Analisis spektrometri massa tandem time-of-flight desorpsi/ionisasi laser berbantuan matriks (MALDI-TOF MS/MS) dilakukan menggunakan instrumen UltrafleXtreme (Bruker, Billerica, MA, AS) dengan laser Smartbeam II menggunakan mode positif linier. Tter16 yang dimurnikan dan dipekatkan dipertukarkan dengan buffer dengan 0,1% (v/v) asam trifluoroasetat dalam dH 2 O hingga volume akhir 0,05 mL dan konsentrasi protein 2 mg mL −1 . Kemudian 0,5 μL campuran 1:1 larutan matriks (50 mg mL −1 SDHB; Bruker) dan sampel (10 ppm) diaplikasikan ke pelat baja yang dipoles (MTP 384; Bruker); mioglobulin (20 ppm) digunakan sebagai standar. Evaluasi sekuens dilakukan menggunakan perangkat lunak BioTools (West Palm Beach, FL, AS).
Hidrolisis kitin-glukan
Kitin-glukan (10 mg mL −1 ) dicuci tiga kali dengan 20 m m buffer McIlvaine pH 5,0 untuk menghilangkan kontaminan mono- dan disakarida, sebagaimana dikonfirmasi oleh analisis HPAEC-PAD dari fraksi pencucian. Untuk setiap reaksi hidrolisis, kitin-glukan yang dicuci pada 10 mg mL −1 dalam 20 mmol L −1 buffer McIlvaine pH 5,0 diinkubasi dengan enzim yang sesuai pada suhu 50 °C dengan pengadukan terus-menerus. Reaksi enzim individual mengandung 25 U Tter16, Csph16A, Csph16A-ΔC, dan 12,5 U Tvir30, sedangkan reaksi campuran enzim mengandung aktivitas tersebut dalam kombinasi. Produk hidrolisis selama 120 menit dipantau dengan membuang 0,5 mL alikuot reaksi (total 10 mL) pada menit ke-10, 20, 60, 90, dan 120. Reaksi dihentikan dengan inaktivasi enzim pada suhu 95 °C selama 5 menit, didinginkan hingga suhu ruangan, dan disentrifugasi pada 14500 × g , 20 °C, selama 10 menit untuk memperoleh fraksi yang larut dan tidak larut. Enzim rekombinan kasar dipanen pada 48 jam induksi metanol, dipekatkan, dan difilter dengan 20 mmol L −1 buffer McIlvaine pH 5,0 untuk membuang 95% zat terlarut.
HPAEC-PAD dan HPSEC
Kromatografi pertukaran anion kinerja tinggi dengan deteksi amperometrik berdenyut (HPAEC-PAD) untuk pemisahan produk hidrolisis kitin-glukan dilakukan menggunakan CarboPac PA200 dan instrumen Dionex ICS-5000 (Thermo Fisher Scientific). Fase bergerak terdiri dari 0,1 mol L −1 NaOH (Buffer A) dan 0,5 mol L −1 NaOAc dalam 0,1 mol L −1 NaOH (Buffer B). Sampel dimasukkan ke dalam kolom dengan volume injeksi 10 μL dan dielusi pada suhu 30 °C dengan laju alir 0,4 mL min −1 . Komposisi fase bergerak terdiri dari 99% Buffer A dan 1% Buffer B dari 0 hingga 4 menit, diikuti oleh peningkatan gradien menjadi 60% Buffer B dan 40% Buffer A pada 10 menit, elusi isokratik pada kondisi tersebut hingga 20 menit, dan kondisi awal lagi pada 20–40 menit. Data yang dihasilkan divisualisasikan dan dianalisis menggunakan perangkat lunak Chromeleon (Thermo Fisher Scientific).
Kromatografi pengecualian ukuran kinerja tinggi (HPSEC) dan perhitungan selanjutnya dilakukan sesuai dengan Biel-Nielson et al ., 2022 menggunakan kolom Shodex SB-806 HQ (Resonac, Tokyo, Jepang) dan standar massa molekul yang berasal dari pullulan. 28
Pengujian aktivitas prebiotik
Larutan 40 mL kitin-glukan 10 mg mL −1 dalam 20 mmol L −1 penyangga McIlvaine pH 5,0 diinkubasi dengan 100 U Tter16, 50 U Tvir30, 50 U Csph16A dan 100 U Csph16A-ΔC selama 90 menit pada suhu 50 °C dengan pengadukan terus-menerus, diinaktivasi dan disentrifugasi seperti dijelaskan di atas. Fraksi yang larut ditambahkan ke volume yang sama dari 100% etanol dan disimpan pada suhu kamar selama 1 jam, diikuti oleh penguapan putar dan pengeringan beku selama 48 jam untuk memperoleh bubuk yang mengandung produk hidrolisis yang larut (yaitu GOS). 29 Oligosakarida disuspensikan kembali dalam dH2O steril hingga mencapai konsentrasi akhir 10% (b/v) dan digunakan untuk melengkapi kultur 1 mL Escherichia coli BL21 (media minimal M9), Lacticaseibacillus rhamnosus ATCC 7469, dan Lactococcus lactis ATCC 15577 (kaldu MRS basal) hingga mencapai 1% (b/v). Potensi prebiotik produk hidrolisis kitin-glukan (GOS) ditentukan melalui skor aktivitas prebiotik (PAS). Inulin, prebiotik yang sudah mapan, digunakan sebagai pembanding. 23 – 25 PAS dihitung sebagai berikut:
![]() di mana PP 24 dan PP 0 adalah konsentrasi sel dalam CFU mL −1 probiotik yang tumbuh pada prebiotik (inulin atau GOS) pada jam ke-24 dan ke-0, masing-masing, dan PG 24 dan PG 0 adalah konsentrasi sel probiotik yang tumbuh pada glukosa pada jam ke-24 dan ke-0, masing-masing. EP 24/0 dan EG 24/0 adalah parameter ekuivalen yang menggambarkan pertumbuhan E. coli BL21, yang berfungsi sebagai kontrol nonprobiotik.
di mana PP 24 dan PP 0 adalah konsentrasi sel dalam CFU mL −1 probiotik yang tumbuh pada prebiotik (inulin atau GOS) pada jam ke-24 dan ke-0, masing-masing, dan PG 24 dan PG 0 adalah konsentrasi sel probiotik yang tumbuh pada glukosa pada jam ke-24 dan ke-0, masing-masing. EP 24/0 dan EG 24/0 adalah parameter ekuivalen yang menggambarkan pertumbuhan E. coli BL21, yang berfungsi sebagai kontrol nonprobiotik.
HASIL DAN PEMBAHASAN
Analisis in silico
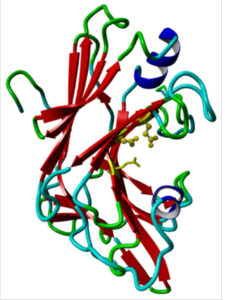
Tter16 berasal dari jamur termofilik Thielavia terrestris NRRL 8126, organisme relevan secara industri yang diketahui menghasilkan enzim yang sangat stabil. 30 Urutannya sepanjang 1457 bp, dengan urutan pengkodean (CDS) sepanjang 852 bp (nomor akses NCBI XM_003652551) dan peptida sinyal yang dikodekan oleh asam amino 1–19. Analisis B lastp mengungkapkan homologi yang tinggi (96–100% cakupan kueri dan identitas sekitar 70%) dengan berbagai endo-β-1,3(4)-glukanase jamur, endo-β-1,3-glukosidase, dan endo-β-1,3-1,4-glukanase dari spesies termotoleran dan termofilik, seperti Thermothelomyces thermophilus . Pencarian domain yang dilestarikan mengonfirmasi keberadaan domain laminarinase-like GH16 Strep yang dicirikan oleh aktivitasnya terhadap ikatan β-1,3 dan mengandung motif katalitik yang dilestarikan ExDxxE pada posisi E132, D134 dan E137 dari protein dewasa (Gbr. 1 ). Urutan asam amino Tter16 tidak diprediksi mengandung situs modifikasi pasca-translasi dan memiliki massa molekul teoritis sebesar 30.726 Da. Model struktural yang dihasilkan menggunakan endo-β-1,3-glukanase dari Streptomyces siyaensis (PDB: 3DGT) sebagai templat mengungkapkan lipatan β-jelly-roll yang menjadi karakteristik enzim dari famili GH16 (Gbr. 1 ). Homologi antara model Tter16 dan templat (3DGT) terutama diamati pada untai-β yang membentuk dua lembar-β cekung dari domain katalitik, dengan divergensi yang lebih besar di daerah loop. Dalam keluarga GH16, variasi antara enzim biasanya diamati pada loop yang menonjol dari domain katalitik, membantu menyempurnakan spesifisitas substrat sambil mempertahankan struktur jelly-roll utama.
 Gambar 1
Gambar 1
Buka di penampil gambar
Presentasi PowerPoint
Model struktural Tter16 matang diprediksi menggunakan Model Swiss dan divisualisasikan menggunakan Model YASARA, menunjukkan karakteristik lipatan β-jelly-roll dari enzim GH16 dan residu katalitik E132, D134 dan E137 berwarna kuning, dengan rantai samping terkaitnya.
Asal usul termofilik Tter16, keberadaan urutan sinyal asli yang kuat yang meningkatkan kemungkinan sekresi efisien dalam sistem ekspresi rekombinan, dan keberadaan domain Lam16 yang berkarakterisasi baik dengan aktivitas yang diketahui terhadap ikatan β-1,3-glikosidik, yang merupakan hubungan yang lazim dalam β-glukan jamur, menggarisbawahi pilihan Tter16 untuk studi lebih lanjut dalam potensi degradasi enzimatik polimer dinding sel jamur dari limbah jamur padat.
Kloning, ekspresi dan pemurnian Tter16
Temuan dari kloning dan pemurnian awal telah dijelaskan secara singkat sebelumnya dalam bentuk abstrak poster. 32 Setelah PCR, amplikon pada <1000 bp diperoleh sesuai dengan panjang CDS Tter16 dengan urutan sinyal asli dan kodon stop dihilangkan (816 bp). Pengurutan konstruksi gen-plasmid mengungkapkan 100% identitas dengan gen asli yang dioptimalkan kodon. Pada 72 jam induksi dengan metanol, ekspresi Tter16 mencapai tingkat aktivitas 1,1 U mL −1 terhadap laminarin pada 50 °C dan pH 6,0 dalam kultur P. pastoris 100 mL . Retensi tag His memungkinkan pemurnian satu langkah Tter16 menggunakan IMAC dengan hasil akhir 43% dan faktor pemurnian 1,81. Protein rekombinan yang dimurnikan muncul sebagai dua pita pada gel SDS-PAGE, pada ≈32.000 dan 35.000 Da. Kedua pita dipastikan memiliki tag His dan tidak mengalami glikosilasi, seperti yang ditunjukkan oleh pewarnaan glikosilasi (Lampiran S1 dalam Informasi pendukung). Keberadaan sisa-sisa urutan sinyal faktor-α dalam bentuk pengulangan Glu-Ala tambahan (EAEA) di N-terminus Tter16 dikonfirmasi oleh analisis MALDI-TOF MS/MS. Massa molekuler ditentukan sebesar 31.924 Da, yang mendekati massa teoritis Tter16 tanpa pengulangan (30.726 Da) dan bahkan lebih dekat dengan massa dengan pengulangan (31.935 Da). Massa ini lebih mungkin terkait dengan pita paling intens pada gel SDS-PAGE, yang menunjukkan bahwa pita yang lebih kecil dan lebih berat di atasnya mungkin mengandung residu peptida sinyal tambahan yang belum terurai.
Tter16 dikloning ke dalam vektor pPICZαA hilir dari sinyal sekresi perkawinan faktor-α dari Saccharomyces cerevisiae , alternatif yang umum dan telah dipelajari dengan baik untuk urutan sinyal asli untuk ekspresi ekstraseluler. Heterogenitas dalam pemrosesan prepropeptida oleh Pichia pastoris telah terdokumentasi dengan baik, dan biasanya menghasilkan pencernaan proteolitik yang tidak lengkap, khususnya oleh protease Ste13. 33 – 35 Cacat pemrosesan biasanya muncul dari kelebihan beban mesin seluler selama ekspresi berlebih, yang mengakibatkan heterogenitas N-terminal yang disebut sebagai ‘ragged ends’. 36 Telah disarankan bahwa efisiensi pembelahan dapat dikompromikan oleh keberadaan residu Prolin di dekat lokasi pembelahan, yang mungkin terjadi pada Tter16 karena mengandung Pro pada posisi 4 dari protein dewasa. Segmen yang tidak dihilangkan dari urutan sinyal dapat memengaruhi sifat protein terlipat, seperti stabilitas dan kinetika pelipatan. 37
Karakterisasi biokimia
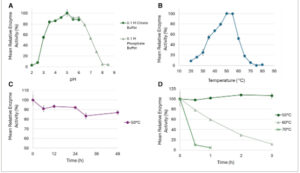
pH optimal untuk aktivitas Tter16 ditemukan sebesar 5,0, konsisten dengan glukanase jamur ekstraseluler, yang biasanya memiliki pH optima antara 4,0 dan 6,0 [Gbr. 2(A) ]. 38 Tter16 mempertahankan ≥80% aktivitasnya pada rentang pH yang luas dari 3,5 hingga 6,5. Enzim tersebut menunjukkan aktivitas puncak pada suhu 50–55 °C, dengan profil suhu yang lebih sempit yang menampilkan aktivitas ≥80% hanya antara suhu 45 dan 55 °C, dan penurunan tajam pada suhu 60 °C [Gbr. 2(B) ]. Meskipun berasal dari jamur termotoleran, Tter16 tidak menunjukkan termofilisitas, tidak seperti ekso-β-1,3-glukanase dari T. terrestris dengan suhu optimum 70 °C. Namun, enzim yang berasal dari jamur termofilik umumnya menunjukkan aktivitas maksimum pada suhu 55–60 °C, seperti endo-β-1,3(4)-glukanase dari Humicola insolens (optimal pada suhu 55 °C), likenase dan endo-β-1,3(4)-glukanase dari Rhizomucor miehei (60 °C), dan likenase dari Malbranchea cinnamomea (55 °C). 39 – 42 Manfaat utama pemrosesan enzimatik dibandingkan hidrolisis asam polimer tradisional adalah bahwa suhu pemrosesan yang tinggi (≥60 °C) biasanya tidak diperlukan, sehingga membuat Tter16 berpotensi cocok.
 Gambar 2
Gambar 2
Buka di penampil gambar
Presentasi PowerPoint
(A) Profil pH dari Tter16 yang dimurnikan ditentukan dengan mengukur aktivitas pada pH 2,0–6,5 0,1 mol L −1 buffer sitrat dan pH 5,5–8,5 0,1 mol L −1 buffer fosfat. Aktivitas relatif 100% pada laminarin 0,5% (b/v) sesuai dengan 5,35 μmol min −1 mL −1 . (B) Profil suhu Tter16 yang dimurnikan. Nilai untuk aktivitas relatif 100% pada laminarin 0,5% (b/v) sesuai dengan 4,88 μmol min −1 mL −1 pada pH 6,0 dalam buffer fosfat 0,1 mol L −1 . (C) Profil stabilitas Tter16 murni pada suhu 50 °C dan pH optimum (pH 5,0), menggunakan 0,5% (b/v) laminarin sebagai substrat, selama rentang waktu 48 jam. Aktivitas 100% setara dengan 5,17 μmol min −1 mL −1 . (D) Profil stabilitas Tter16 pada suhu 55, 60, dan 70 °C pada pH optimum menggunakan 0,5% (b/v) oat β-glukan sebagai substrat selama periode 3 jam. Aktivitas 100% setara dengan 80,78, 82,96, dan 43,43 μmol min −1 mL −1 untuk suhu 55, 60, dan 70 °C. Semua nilai menunjukkan mean ± SD, n = 3.
Tter16 menunjukkan hipertermosabilitas pada suhu 50 °C dan pH 5,0, mempertahankan 87% dari aktivitas relatif rata-ratanya setelah 48 jam inkubasi, dengan nilai D (waktu yang diperlukan aktivitas enzim untuk menurun hingga 10% dari nilai awalnya) 33 hari [Gbr. 2(C) ]. Termostabilitas juga dipertahankan pada suhu 55 °C (aktivitas 100% setelah 3 jam inkubasi), tetapi tidak pada suhu 60 °C atau 70 °C, di mana aktivitas enzim menurun hingga ≤10% setelah 3 jam [Gbr. 2(D) ]. Termostabilitas Tter16 yang diperpanjang pada suhu 50 °C cukup menjanjikan dalam konteks reaksi industri karena meminimalkan kebutuhan pengisian ulang enzim pada suhu pemrosesan ini, sehingga berpotensi mengurangi biaya produksi. Tm dari Tter16 ditetapkan sebesar 67,77 °C, yang menunjukkan suhu leleh yang relatif tinggi dan mencerminkan asal enzim yang toleran terhadap panas. Meskipun demikian, tidak ada stabilitas termal yang signifikan yang diamati pada suhu 60 °C atau 70 °C, yang menunjukkan bahwa enzim tersebut memiliki stabilitas kinetik yang sedang. Meskipun ambang batas untuk denaturasi reversibel cukup tinggi, sebagaimana dibuktikan oleh Tm, akumulasi keadaan denaturasi ireversibel yang tidak terlipat terjadi dengan cepat pada suhu yang melebihi 55 °C, sehingga menghasilkan suhu pemrosesan maksimal.
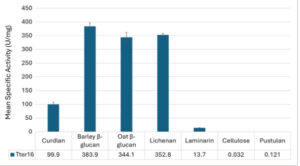
Analisis spesifisitas substrat menunjukkan bahwa Tter16 paling aktif pada substrat ikatan campuran yang mengandung ikatan β-1,3 dan β-1,4, seperti β-glukan barley, β-glukan oat, dan lichenan (Gbr. 3 ). Tingkat aktivitas yang lebih rendah diamati pada curdlan dan laminarin, yang menggolongkan enzim sebagai endo-β-1,3(4)-glukanase (EC 3.2.1.6). Enzim bekerja pada ikatan β-1,3 dan β-1,4, tetapi dalam kasus yang terakhir hanya ketika residu glukosa masing-masing tersubstitusi pada posisi O3 – oleh karena itu kurangnya aktivitas pada selulosa yang ditunjukkan pada Gbr. 3 . Sebaliknya, aktivitas signifikan pada curdlan dan laminarin, yaitu substrat yang tidak memiliki ikatan β-1,4, mengesampingkan kemungkinan Tter16 bertindak sebagai lichenase (endo-β-1,3:1,4-glukanase), karena kelas enzim ini menghidrolisis ikatan β-1,3 hanya ketika residu glukosa tersubstitusi pada C4.
Sifat kinetik Tter16 ditentukan dalam kondisi reaksi optimum, yaitu pada suhu 50 °C dan pH 5,0, menggunakan β-glukan barley sebagai substrat (0,5–8 mg mL −1 ) dalam uji 10 menit. Konstanta reaksi berikut dihitung: Km sebesar 3,68 mg mL −1 , Vmaks sebesar 1832 μmol mg −1 menit −1 , kcat sebesar 1221 s −1 dan kcat / Km pada 331,79 mL mg −1 s −1 . Kcat Tter16 relatif tinggi, sejauh pengetahuan kami hanya dua β-glukanase jamur lain yang dipublikasikan yang menampilkan nilai kcat > 1000 s −1 , salah satunya adalah endo-β-1,3(4) glukanase . 39 , 40 Selain itu, sepengetahuan kami Tter16 menampilkan salah satu efisiensi katalitik tertinggi di antara β-glukanase jamur nonselulolitik yang dikarakterisasi, menunjukkan potensi penerapan industrinya (Lampiran S2 ).
Degradasi enzimatik gabungan kitin-glukan
Campuran empat enzim rekombinan: Tter16, Tvir30, Csph16A dan Csph16A-ΔC, diinkubasi dengan polimer kitin-glukan jamur dan produksi gula larut dipantau selama 120 menit hidrolisis. Csph16A dan varian rekayasanya Csph16A-ΔC keduanya adalah endo-β-1,3(4)-glukanase dengan aktivitas transglikosilase, sedangkan Tvir30 adalah endo-β-1,6-glukanase (Lampiran S3 ). Kedua enzim Csph16A secara bersamaan disertakan dalam reaksi karena mereka menghasilkan profil oligosakarida yang berbeda namun saling melengkapi (Lampiran S3 ). Pilihan enzim mencerminkan komposisi substrat, yang merupakan polisakarida heterogen yang terdiri dari ikatan β-1,3-, β-1,6-, dan β-1,4-glikosidik.
Resolusi oligosakarida tak bercabang pada kolom CarboPac PA200 dibatasi hingga sekitar DP17 untuk monomer glukosa yang terikat β-1,2, sebagaimana ditentukan dalam buku petunjuk untuk kolom tersebut (Thermo Fisher Scientific). Selama analisis HPAEC terhadap produk hidrolisis yang dibebaskan antara 10 dan 120 menit, 22 hingga 26 puncak individual diidentifikasi, yang sesuai dengan oligosakarida dengan berat molekul rendah.
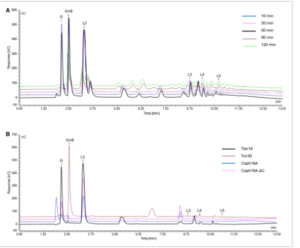
Kromatogram overlay HPAEC menunjukkan bahwa pada menit ke-10, ke-20, dan ke-60 produk hidrolisis yang dominan adalah glukosa, gentiobiosa, dan laminaribiosa, yang mencakup 61,5% dari luas puncak relatif semua produk yang terpecahkan (diketahui dan tidak diketahui) [Gbr. 4(A) ]. Namun, pada menit ke-90 reaksi hidrolisis, profil oligosakarida sangat menguntungkan untuk aplikasi prebiotik karena penghilangan glukosa secara menyeluruh, gula non-prebiotik, dan pembentukan oligosakarida yang lebih besar dengan waktu retensi >10 menit (Tabel 1 ). Pada menit ke-120, komposisi oligosakarida tetap tidak berubah. Konsentrasi total gula yang diketahui (μg mL −1 ) ditemukan paling tinggi pada menit ke-60, menurun sekitar 75% pada menit ke-90 dan ke-120. Hal ini tidak menunjukkan pengurangan dalam konsentrasi semua gula terlarut, tetapi terutama merupakan konsekuensi dari peralihan dari gula kecil yang diketahui ke gula yang lebih besar sebagai konsekuensi aktivitas transglikosilasi.
 Gambar 4
Gambar 4
Buka di penampil gambar
Presentasi PowerPoint
Hamparan kromatogram HPAEC yang dihasilkan untuk (A) setiap titik waktu selama hidrolisis 120 menit menggunakan Tter16, Tvir30, Csph16A dan Csph16A-ΔC, dan (B) setiap enzim selama 1 jam hidrolisis enzim polimer kitin-glukan jamur. Setiap reaksi dilakukan pada suhu 50 °C dalam 20 mmol L −1 penyangga McIlvaine, pH 5,0. Puncak berlabel sesuai dengan standar yang diketahui di mana G adalah glukosa, GnB adalah gentiobiosa, L2 adalah laminaribiosa, L3 adalah laminaritriosa, L4 adalah laminaritetraosa dan L5 adalah laminaripentaosa.
Tabel 1. Konsentrasi (μg mL −1 ) produk hidrolisis yang diketahui dilepaskan dari kitin-glukan selama 120 menit pencernaan dengan Tter16, Tvir30, Csph16A dan Csph16A-ΔC pada suhu 50 °C, pH 5,0
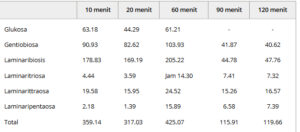 Produk hidrolisis kemungkinan sangat heterogen dengan berbagai jenis ikatan dan konformasi percabangan karena sifat substrat yang kompleks, yang mengandung bentangan polimer ikatan β-1,3 yang tidak bercabang yang diselingi dengan ikatan β-1,4 dan titik cabang β-1,6 sesekali. Cabang-cabang tersebut kemungkinan terdiri dari bentangan pendek oligosakarida ikatan β-1,6 atau rantai β-1,3-glukan yang lebih panjang. Sebagian besar puncak tidak dapat diidentifikasi dengan jelas karena tidak tersedianya standar yang relevan. Sediaan oligosakarida yang beragam dapat bermanfaat dalam prebiotik komersial karena potensi stimulasi berbagai mikroorganisme di bagian distal dan proksimal usus besar. 43
Produk hidrolisis kemungkinan sangat heterogen dengan berbagai jenis ikatan dan konformasi percabangan karena sifat substrat yang kompleks, yang mengandung bentangan polimer ikatan β-1,3 yang tidak bercabang yang diselingi dengan ikatan β-1,4 dan titik cabang β-1,6 sesekali. Cabang-cabang tersebut kemungkinan terdiri dari bentangan pendek oligosakarida ikatan β-1,6 atau rantai β-1,3-glukan yang lebih panjang. Sebagian besar puncak tidak dapat diidentifikasi dengan jelas karena tidak tersedianya standar yang relevan. Sediaan oligosakarida yang beragam dapat bermanfaat dalam prebiotik komersial karena potensi stimulasi berbagai mikroorganisme di bagian distal dan proksimal usus besar. 43
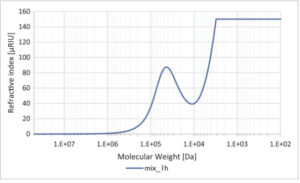
Kromatografi pengecualian ukuran kinerja tinggi (HPSEC) menggunakan standar turunan pullulan mendeteksi elusi molekul antara 18 dan 23 menit, yang sesuai dengan massa molekul 10 6 hingga 10 2 Da. Gambar 5 menunjukkan bahwa reaksi campuran enzim membebaskan gula larut dengan massa molekul 10 5 –10 3 Da dalam 1 jam bersama dengan spesies yang lebih kecil yang dipecahkan oleh HPAEC. Sampel dimuat sebagai reaksi hidrolisis enzim mentah yang tidak diencerkan, yang menyebabkan puncak besar (di luar batas deteksi) pada ~100 Da. Hasil ini menunjukkan bahwa campuran enzim secara efektif mendegradasi polimer β-glukan yang sangat terikat silang dan heterogen melalui pembelahan ikatan internal acak, melepaskan gula larut dengan berbagai massa molekul.
 Gambar 5
Gambar 5
Buka di penampil gambar
Presentasi PowerPoint
Kromatografi pengecualian ukuran kinerja tinggi dari fraksi terlarut dari campuran enzim (Tter16, Tvir30, Csph16A, Csph16A-ΔC) yang bekerja pada kitin-glukan (1 mg mL −1 ) selama 1 jam pada suhu 50 °C, pH 5,0. Sampel dimasukkan ke dalam kolom (kolom Shodex SB-806 HQ) tanpa pengenceran. Standar MW berasal dari pullulan.
Peran masing-masing enzim dalam hidrolisis kitin-glukan diteliti melalui inkubasi enzim secara individual dengan substrat. Kromatogram overlay untuk keempat enzim disediakan dalam Gambar 4(B) dan konsentrasi gula larut yang diketahui dalam Tabel 2 .
Tabel 2. Konsentrasi (dalam μg mL −1 ) produk hidrolisis yang diketahui dilepaskan dari kitin-glukan setelah 1 jam pencernaan dengan enzim individu pada suhu 50 °C, pH 5,0
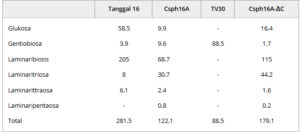 Hasil menunjukkan bahwa Tter16 terutama bertanggung jawab atas pelepasan glukosa pada menit ke-60 selama reaksi gabungan. Selain glukosa, Tter16 menghasilkan sejumlah kecil gentiobiosa dan terutama laminaribiosa (205 μg mL −1 ), yang mencakup 50% dari luas puncak relatif. Sejumlah kecil laminaritriosa (8 μg mL −1 ) dan laminaritetraosa (6,1 μg mL −1 ) terdeteksi, yang mencakup 1–2% dari luas puncak relatif. Tujuh puncak tambahan, yang berpotensi oligosakarida yang lebih besar, juga diamati.
Hasil menunjukkan bahwa Tter16 terutama bertanggung jawab atas pelepasan glukosa pada menit ke-60 selama reaksi gabungan. Selain glukosa, Tter16 menghasilkan sejumlah kecil gentiobiosa dan terutama laminaribiosa (205 μg mL −1 ), yang mencakup 50% dari luas puncak relatif. Sejumlah kecil laminaritriosa (8 μg mL −1 ) dan laminaritetraosa (6,1 μg mL −1 ) terdeteksi, yang mencakup 1–2% dari luas puncak relatif. Tujuh puncak tambahan, yang berpotensi oligosakarida yang lebih besar, juga diamati.
Tvir30 terutama menghasilkan gentiobiosa melalui pembelahan titik cabang yang terhubung dengan β-1,6. Csph16A menghasilkan gula yang tidak teridentifikasi yang keluar sebelum glukosa, bersama dengan sejumlah kecil glukosa dan gentiobiosa. Produk hidrolisis utamanya adalah laminaribiosa (68,7 μg mL −1 ). Selain itu, laminaritetraosa dan laminaripentaosa terdeteksi. Dibandingkan dengan Tter16, Csph16A menghasilkan lebih banyak puncak dengan waktu retensi elusi yang lebih lama. Profil oligosakarida dari mutan terpotong Csph16A-ΔC berbeda dari enzim tipe liar karena glukosa, yang muncul sebagai puncak pertama, diproduksi hingga konsentrasi 16,4 μg mL −1 , yang lebih besar daripada yang diproduksi oleh Csph16A pada 9,89 μg mL −1 . Hal ini disebabkan oleh Vmax dan kcat yang lebih tinggi dari varian terpotong. Menariknya, Csph16A-ΔC menghasilkan gentiobiosa yang jauh lebih sedikit tetapi hanya kalah dari Tter16 dalam produksi laminaribiosa pada 1 jam. Selain itu, laminaritriosa, laminaritetraosa, dan laminaripentaosa juga diidentifikasi .
Model yang diusulkan untuk degradasi enzimatik gabungan kitin-glukan adalah sebagai berikut: Tvir30 dan Tter16 menunjukkan afinitas kuat untuk ikatan β-1,6 dan β-1,3 dalam β-glukan, masing-masing. Hal ini tercermin dari nilai K m yang rendah , yang memulai produksi glukosa, gentiobiosa, laminaribiosa, dan laminaritriosa. Csph16A, dengan K m yang tinggi untuk ikatan campuran β-glukan, cenderung memulai hidrolisis pada tingkat yang lebih lambat (Tabel 2 ). Ketika kesetimbangan substrat bergeser ke arah gula yang lebih kecil, seperti pada menit ke-60, Csph16A berfungsi sebagai transglikosilase (sebagaimana ditentukan oleh TLC; Lampiran S3 ), memfasilitasi ikatan silang oligosakarida DP rendah menjadi gula yang lebih besar. Hilangnya gula-gula dengan massa molekul rendah ini selanjutnya menunjukkan bahwa gula-gula tersebut diubah menjadi gula yang lebih besar, yang tidak dapat ditampung oleh situs-situs aktif Tter16 dan Tvir30. Berdasarkan hasil hidrolisis enzim secara berkala dan individual, setiap enzim memainkan peran yang berbeda dalam profil oligosakarida akhir, yang diteliti untuk aktivitas prebiotik.
Skor aktivitas prebiotik (PAS) ditentukan untuk dua mikroorganisme probiotik representatif, L. rhamnosus dan L. coccus [Persamaan ( 1 )]. Setelah pengeringan beku, 0,097 g gula terlarut (GOS) diperoleh dari 0,4 g kitin-glukan – hasil sebesar 24,3%. Analisis oleh HPAEC mengidentifikasi gula yang diketahui (terutama gentiobiosa dan laminaribiosa) yang hanya mencakup 3,4% dari gula yang dipulihkan. Glukosa mencakup 0,5% dari total massa produk hidrolisis yang dikeringkan beku. Sisanya 0,0818 g terdiri dari gula yang dilarutkan menggunakan kolom CarboPac PA200 yang tidak sesuai dengan standar yang diketahui, serta gula terlarut yang lebih besar berkisar antara 10 3 hingga 10 5 Da.
Suplementasi media kultur dengan GOS yang dikeringkan beku menunjukkan PAS positif yang besar pada L. rhamnosus , yang sebanding dengan inulin, prebiotik yang sudah dikenal (Tabel 3 ). Pertumbuhan L. lactis tidak didukung oleh GOS. Merupakan hal yang umum bagi kelas prebiotik tertentu untuk memfasilitasi pertumbuhan beberapa, tetapi tidak semua, mikroorganisme probiotik. 23 Fenomena ini terkait dengan keberadaan hidrolase spesifik dalam sekretom salah satu spesies probiotik.
Tabel 3. Dua skor aktivitas prebiotik inulin, prebiotik yang sudah dikenal, dan produk hidrolisis kitin-glukan (GOS) dan nilai rata-rata ± SD-nya
 KESIMPULAN
KESIMPULAN
Sebagai kesimpulan, studi ini melaporkan keberhasilan produksi, pemurnian, dan karakterisasi endo-β-1,3(4)-glukanase baru dengan nilai k cat yang sangat tinggi , yaitu 1221 s −1 . Studi pembuktian konsep berikutnya, yang menggunakan Tter16 dalam kombinasi dengan transglikosilase Csph16A dan Csph16A-ΔC, dan endo-β-1,6-glukanase Tvir30, menggambarkan – untuk pertama kalinya sejauh pengetahuan kami – degradasi enzimatik kitin-glukan jamur menjadi gluko-oligosakarida dengan potensi prebiotik. Hal ini menunjukkan strategi untuk valorisasi limbah produksi jamur, yang menghasilkan GOS prebiotik bernilai tambah. Penerapan industri yang sebenarnya akan memerlukan optimalisasi pemuatan enzim dan kondisi reaksi.

